Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 11 Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base sách Cánh diều. Bài viết gồm 15 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 11. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base. Mời các bạn đón xem:
Trắc nghiệm Hóa học 11 Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Phần 1. Trắc nghiệm Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Câu 1. Trong dung dịch nitric acid (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, NO3-.
B. H+, NO3-, H2O.
C. H+, NO3-, HNO3.
D. H+, NO3-, HNO3, H2O.
Đáp án đúng là: B
HNO3 là chất điện li mạnh.
=> Trong dung dịch nitric acid (bỏ qua sự phân li của H2O) có những phần tử: H+, NO3-, H2O.
Câu 2. Trong dung dịch acetic acid (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, CH3COO−.
B. H+, CH3COO−, H2O.
C. CH3COOH, H+, CH3COO−, H2O.
D. CH3COOH, CH3COO−, H+.
Đáp án đúng là: D
CH3COOH là chất điện li yếu.
=> Trong dung dịch acetic acid (bỏ qua sự phân li của H2O) có những phần tử: CH3COOH, H+, CH3COO−, H2O.
Câu 3. Trong phản ứng sau đây:
Những chất nào đóng vai trò là acid theo thuyết Bronsted – Lowry?
A. H2S và H2O.
B. H2S và H3O+.
C. H2S và HS−.
D. H2O và H3O+.
Đáp án đúng là: B
Trong phản ứng thuận, H2S là acid; trong phản ứng nghịch H3O+ là acid.
Câu 4. Các chất trong dãy nào sau đây là những chất điện li mạnh?
A. HCl, NaOH, CH3COOH.
B. KOH, NaCl, H3PO4.
C. HCl, NaOH, NaCl.
D. NaNO3, NaNO2, NH3.
Đáp án đúng là: C
Chất điện li mạnh gồm: acid mạnh, base mạnh và hầu hết các muối.
Vậy HCl, NaOH, NaCl là chất điện li mạnh.
Câu 5. Dung dịch chất nào sau đây (có cùng nồng độ) dẫn điện tốt nhất?
A. K2SO4.
B. KOH.
C. NaCl.
D. KNO3.
Đáp án đúng là: A
Do các dung dịch có cùng nồng độ, dung dịch nào có nồng độ ion càng lớn thì dẫn điện càng tốt. Vậy dung dịch K2SO4 dẫn điện tốt nhất.
Câu 6. Chất nào sau đây không phải chất điện li?
A. KOH.
B. H2S.
C. HNO3.
D. C2H5OH.
Đáp án đúng là: D
C2H5OH không phải là chất điện li.
Loại KOH, H2S, HNO3 do acid, base, muối là các chất điện li.
Câu 7. Chất nào sau đây thuộc loại chất điện li mạnh?
A. CH3COOH.
B. C2H5OH.
C. H2O.
D. NaCl.
Đáp án đúng là: D
NaCl là chất điện li mạnh.
Loại A do CH3COOH là acid yếu, chất điện li yếu.
Loại B do C2H5OH là chất không điện li.
Loại C do H2O là chất điện li yếu.
Câu 8. Chất nào sau đây thuộc loại chất điện li yếu?
A. NaHCO3.
B. C2H5OH.
C. H2S.
D. NH4Cl.
Đáp án đúng là: C
H2S là acid yếu, chất điện li yếu.
Câu 9. Phương trình điện li viết đúng là
A. H2SO4 → 2H+ + SO4−
B. NaOH Na+ + OH−
C. HF H+ + F-
D. AlCl3 → Al3+ + Cl3-
Đáp án đúng là: C
Phát biểu A sai vì:
Phát biểu B sai vì:
Phát biểu D sai vì:
Câu 10. Phương trình điện li nào sau đây không đúng?
A.
B. K2SO4 2K+ +
C. HF H+ + F−.
D. BaCl2 → Ba2+ + 2Cl−.
Đáp án đúng là: B
Do K2SO4 là chất điện li mạnh.
K2SO4 → 2K+ +
Câu 11. Các dung dịch sau đây có cùng nồng độ 0,10 mol/L, dung dịch nào dẫn điện kém nhất?
A. HCl.
B. HF.
C. HI.
D. HBr.
Đáp án đúng là: B
Trong số các chất HF, HCl, HBr, HI chỉ có HF là chất điện li yếu, do đó dung dịch HF dẫn điện kém nhất.
Câu 12. Nồng độ mol của ion Na+ trong dung dịch Na2SO4 0,2 M là
A. 0,2 M.
B. 0,1 M.
C. 0,4 M.
D. 0,5 M.
Đáp án đúng là: C
Câu 13. Hòa tan hoàn toàn 12,4 gam Na2O vào nước dư thu được 500 mL dung dịch X. Nồng độ mol của cation trong X là
A. 0,4 M.
B. 0,8 M.
C. 0,2 M.
D. 0,5 M.
Đáp án đúng là: B
Na2O + H2O → 2NaOH
0,2 0,4 mol
NaOH → Na+ + OH−
0,8 0,8 M.
Câu 14. Cho các chất dưới đây: HClO4, HClO, HF, HNO3, H2S, H2SO3, NaOH, NaCl, CuSO4, CH3COOH. Số chất thuộc loại chất điện li mạnh là
A. 5.
B. 6.
C. 7.
D. 4.
Đáp án đúng là: A
Các chất thuộc loại chất điện li mạnh là: HClO4, HNO3, NaOH, NaCl, CuSO4.
Câu 15. Cho các phản ứng sau:
HCl + H2O Cl− + H3O+ (1);
NH3 + H2O + OH− (2)
CuSO4 + 5H2O CuSO4.5H2O (3);
+ H2O H3O+ + (4)
+ H2O H2SO3 + OH− (5)
Theo Bronsted, H2O đóng vai trò là acid trong các phản ứng là
A. (1), (2), (3).
B. (2), (5).
C. (2), (3), (4), (5).
D. (1), (4), (5).
Đáp án đúng là: B
Trong phản ứng (2) và (5) H2O nhường proton nên đóng vai trò là acid.
Phần 2. Lý thuyết Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
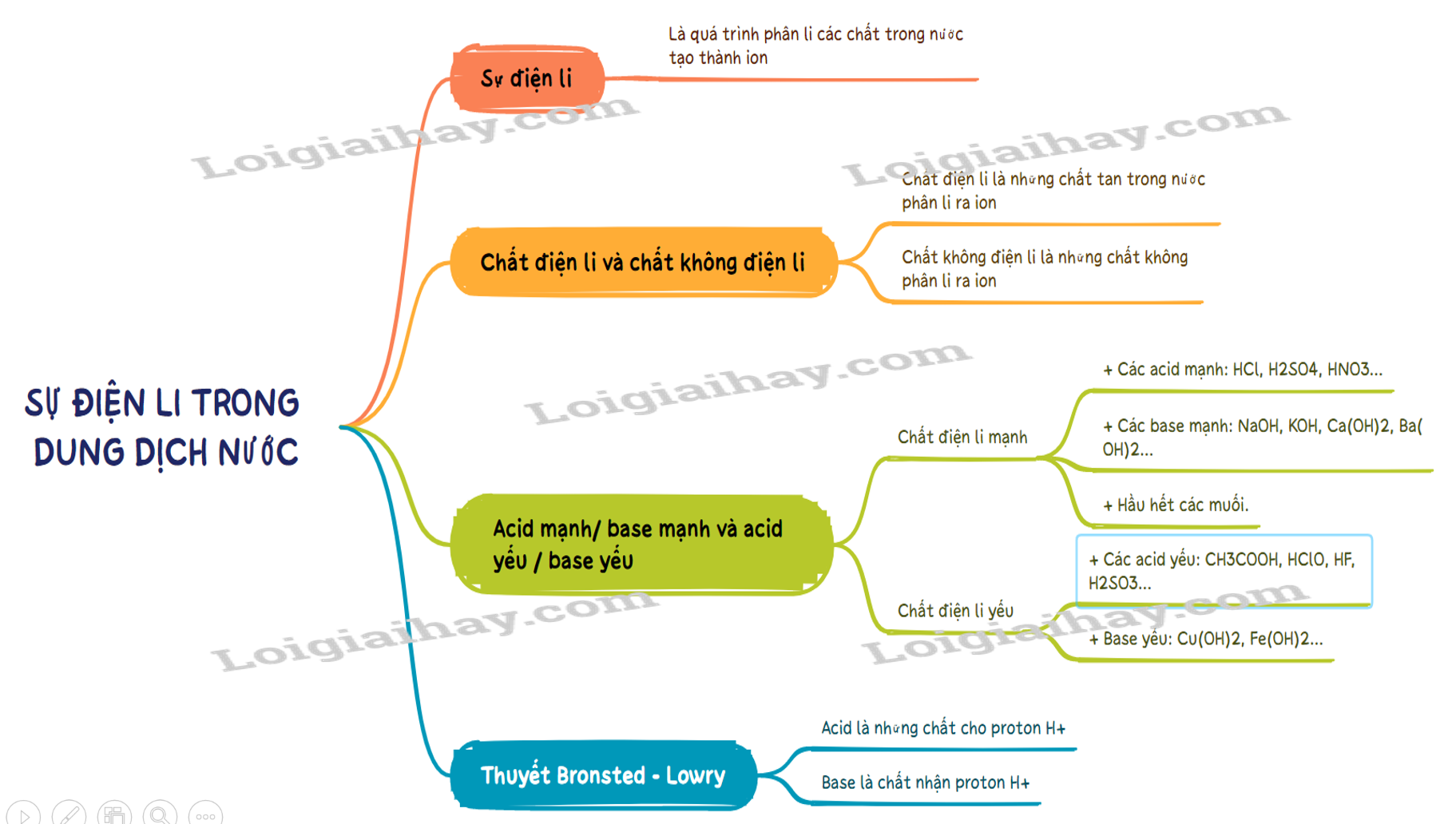
I. Sự điện li, chất điện li và chất không điện li
1. Sự điện li
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion.
2. Chất điện li và chất không điện li
- Chất điện li là những chất khi tan trong nước phân li ra các ion
- Chất điện li là những chất tan trong nước phân li ra các ion. VD: hydrochloric acid, sodium hydroxide, ..
- Chất không điện li là chất không phân li ra các ion. VD: saccarose, ethanol….
II. Thuyết Bronsted – Lowry về acid – base
1. Thuyết Bronsted – Lowry về acid – base
a. Khái niệm acid – base theo thuyết Bronsted – Lowry.
- Acid là chất cho proton (H+).
- Base là chất nhận proton (H+).
b. Ưu điểm của thuyết Bronsted – Lowry.
Tổng quát hơn thuyết Arhenius. (Phân tử không có nhóm –OH như NH3 hay CO3- cũng là base).
2. Acid mạnh / base mạnh và acid yếu / base yếu
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Thường gặp là:
+ Các acid mạnh: HCl, H2SO4, HNO3…
+ Các base mạnh: NaOH, KOH, Ca(OH)2, Ba(OH)2…
+ Hầu hết các muối.
Phản ứng: Một chiều.
Biểu diễn: Mũi tên một chiều (→).
VD: HNO3 → H+ + NO3-.
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần phân tử chất tan phân li ra ion. Thường gặp là:
+ Các acid yếu: CH3COOH, HClO, HF, H2SO3…
+ Base yếu: Cu(OH)2, Fe(OH)2…
Phản ứng: Thuận nghịch.
Biểu diễn: Hai nửa mũi tên ngược nhau (⇆)
VD: CH3COOH ⇆ CH3COO- + H+.
Sơ đồ tư duy Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Xem thêm các bài Trắc nghiệm Hóa học lớp 11 Cánh diều hay, chi tiết khác: