Với giải sách bài tập Khoa học tự nhiên 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Khoa học tự nhiên 7. Mời các bạn đón xem:
Giải SBT Khoa học tự nhiên lớp 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
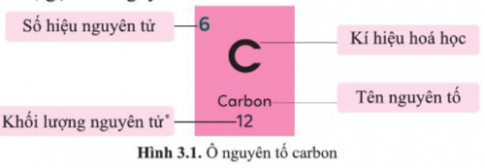
Bài 3.1 trang 9 SBT Khoa học tự nhiên 7: Thông tin trên ô nguyên tố trong bảng tuần hoàn cho biết:
A. số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và số lớp electron của nguyên tố đó.
B. số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và số electron lớp ngoài cùng của nguyên tố đó.
C. số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và khối lượng nguyên tử của nguyên tố đó.
D. số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và số điện tích hạt nhân của nguyên tố đó.
Lời giải:
Đáp án đúng là: C
Thông tin trên ô nguyên tố trong bảng tuần hoàn cho biết: số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và khối lượng nguyên tử của nguyên tố đó.

Lời giải:
1 – c, e, h.
2 – a.
3 – d.
4 – g.
5 – b.
|
Số thứ tự ô nguyên tố |
Tên nguyên tố |
Kí hiệu hóa học |
Số proton |
Số electron |
Chu kì |
Nhóm |
|
|
|
|
|
8 |
|
|
|
|
|
|
18 |
|
|
|
|
|
|
|
|
13 |
|
|
|
19 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
VIIA |
|
|
|
|
|
|
3 |
IIA |
|
|
Phosphorus |
P |
|
|
|
|
|
|
Silicon |
Si |
|
|
|
|
Lời giải:
|
Số thứ tự ô nguyên tố |
Tên nguyên tố |
Kí hiệu hóa học |
Số proton |
Số electron |
Chu kì |
Nhóm |
|
8 |
Oxygen |
O |
8 |
8 |
2 |
VIA |
|
18 |
Argon |
Ar |
18 |
18 |
3 |
VIIIA |
|
13 |
Aluminium |
Al |
13 |
13 |
3 |
IIIA |
|
19 |
Potassium |
K |
19 |
19 |
4 |
IA |
|
9 |
Fluorine |
F |
9 |
9 |
2 |
VIIA |
|
12 |
Magnesium |
Mg |
12 |
12 |
3 |
IIA |
|
15 |
Phosphorus |
P |
15 |
15 |
3 |
VA |
|
14 |
Silicon |
Si |
14 |
14 |
3 |
IVA |
Bài 3.4 trang 10 SBT Khoa học tự nhiên 7: Những phát biểu nào trong các phát biểu dưới đây là đúng?
a) Khối lượng của một nguyên tử bằng tổng số proton của nguyên tử đó.
b) Tất cả nguyên tử của các nguyên tố nhóm VA đều có 5 electron ở lớp ngoài cùng.
c) Tất cả nguyên tử của các nguyên tố ở chu kì II đều có 2 electron ở lớp ngoài cùng.
d) Trong nguyên tử, các electron được xếp theo từng lớp. Các electron được sắp xếp lần lượt vào các lớp theo chiều từ gần hạt nhân ra ngoài. Mỗi lớp electron có một số electron nhất định.
e) Số thứ tự của nhóm bằng số lớp electron trong nguyên tử của các nguyên tố thuộc nhóm đó.
g) Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của các nguyên tố thuộc chu kì đó.
Lời giải:
Các phát biểu b, d, g đúng.
- Phát biểu a sai vì khối lượng nguyên tử được coi bằng tổng khối lượng của proton và neutron có trong nguyên tử.
- Phát biểu c sai vì số thứ tự của chu kì được đánh số từ 1 đến 7, không dùng số La mã.
- Phát biểu e sai vì số thứ tự của nhóm A bằng số electron lớp ngoài cùng trong nguyên tử của nguyên tố thuộc nhóm đó.
A. ô số 9, chu kì 3, nhóm IA.
B. ô số 10, chu kì 2, nhóm IA.
C. ô số 12, chu kì 3, nhóm IA.
D. ô số 11, chu kì 3, nhóm IA.
Lời giải:
Đáp án đúng là: D
M có 3 lớp electron nên thuộc chu kì 3 ⇒ Loại đáp án B.
M có 1 electron ở lớp ngoài cùng nên thuộc nhóm IA.
M có 3 lớp electron trong đó: lớp thứ nhất có 2 electron, lớp thứ hai có 8 electron, lớp thứ 3 có 1 electron ⇒ M có 11 electron. Vậy M thuộc ô 11 trong bảng tuần hoàn.
A. Nguyên tố X ở chu kì 3, nhóm VIIA; là phi kim; có 17 proton, 7 electron.
B. Nguyên tố X ở chu kì 3, nhóm VIIA; là phi kim; có 17 proton, 17 electron.
C. Nguyên tố X ở chu kì 2, nhóm VIIA; là kim loại; có 17 proton, 17 electron.
D. Nguyên tố X ở chu kì 2, nhóm VIIA; là phi kim; có 17 proton, 7 electron.
Lời giải:
Đáp án đúng là: B
- X có điện tích hạt nhân là +17 nên nguyên tử X có 17 proton và 17 electron (loại đáp án A và D).
- X có 17 electron được phân vào 3 lớp, vậy X thuộc chu kì 3 (loại đáp án C).
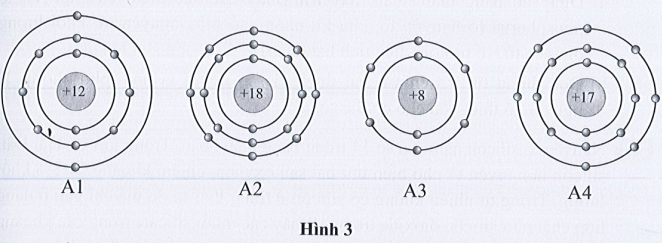
Điền các thông tin còn thiếu vào bảng sau đây:
|
Nguyên tử nguyên tố |
A1 |
A2 |
A3 |
A4 |
|
Số lớp electron |
|
|
|
|
|
Số electron lớp ngoài cùng |
|
|
|
|
|
Số hiệu nguyên tử |
|
|
|
|
|
Số proton |
|
|
|
|
Lời giải:
Chú ý: Trong nguyên tử:
Số hiệu nguyên tử = số proton = số electron.
|
Nguyên tử nguyên tố |
A1 |
A2 |
A3 |
A4 |
|
Số lớp electron |
3 |
3 |
2 |
3 |
|
Số electron lớp ngoài cùng |
2 |
8 |
6 |
7 |
|
Số hiệu nguyên tử |
12 |
18 |
8 |
17 |
|
Số proton |
12 |
18 |
8 |
17 |
Bài 3.8 trang 11 SBT Khoa học tự nhiên 7: Quan sát bảng tuần hoàn các nguyên tố hóa học và cho biết:
a) Một số thông tin (ô nguyên tố, chu kì, nhóm; là nguyên tố kim loại, phi kim hay khí hiếm) của những nguyên tố có số thứ tự lần lượt là 6, 9 và 19.
b) Vì sao các nguyên tố Li, Na và K được xếp vào cùng một cột/ nhóm? Giải thích tương tự với các nguyên tố O, S và Se.
c) Vì sao các nguyên tố B, C, N, O và F được xếp vào cùng một hàng/ chu kì? Giải thích tương tự với các nguyên tố Na, Mg và Al.
d) Vì sao các nguyên tố He, Ne và Ar được xếp vào cùng một cột/ nhóm?
Lời giải:
a) Một số thông tin (ô nguyên tố, chu kì, nhóm; là nguyên tố kim loại, phi kim hay khí hiếm) của những nguyên tố có số thứ tự lần lượt là 6, 9 và 19 được thể hiện trong bảng sau:
|
Ô nguyên tố |
Tên nguyên tố |
Kí hiệu hóa học |
Số proton |
KLNT |
Số electron |
Chu kì |
Nhóm |
Loại nguyên tố |
|
6 |
Carbon |
C |
6 |
12 |
6 |
2 |
IVA |
Phi kim |
|
9 |
Fluorine |
F |
9 |
19 |
9 |
2 |
VIIA |
Phi kim |
|
19 |
Potassium |
K |
19 |
39 |
19 |
4 |
IA |
Kim loại |
b)
- Các nguyên tố Li, Na và K được xếp vào cùng một cột (cùng nhóm IA) vì cả 3 nguyên tố này đều có 1 electron ở lớp ngoài cùng.
- Tương tự, các nguyên tố O, S và Se được xếp vào cùng một cột (nhóm VIA) vì cả 3 nguyên tố đều có 6 electron ở lớp ngoài cùng.
c)
- Các nguyên tố B, C, O và F được xếp vào cùng 1 hàng (chu kì 2) vì cả 5 nguyên tố này đều có 2 lớp electron trong nguyên tử.
- Tương tự, các nguyên tố Na, Mg và Al được xếp vào cùng 1 hàng (chu kì 3) vì nguyên tử của các nguyên tố này đều có 3 lớp electron.
d)
Các nguyên tố He, Ne và Ar đều được xếp vào cùng một cột (nhóm VIIIA) vì cả hai nguyên tố Ne và Ar đều có 8 electron ở lớp ngoài cùng, còn nguyên tố He (đặc biệt) chỉ có 2 electron ở lớp ngoài cùng.
Số electron lớp ngoài cùng là 8 (riêng với He là 2) là cấu trúc bền vững và nhóm này còn có tên gọi là các nguyên tố khí hiếm.
Lời giải:
- Nguyên tử nguyên tố X có điện tích hạt nhân là +8 nên số hiệu nguyên tử X là 8.
Vậy X thuộc ô nguyên tố có số thứ tự là 8, chu kì 2 (vì có 2 lớp electron), nhóm VIA (vì có 6 electron ở lớp ngoài cùng).
- Nguyên tố X là nguyên tố oxygen, là nguyên tố phi kim.
- Một số hiểu biết của em về nguyên tố oxygen: Nguyên tố oxygen tạo nên chất oxygen; là một chất khí, không màu, không mùi, không vị, ít tan trong nước, chiếm khoảng 1/5 thể tích không khí. Oxygen suy trì sự sống và sự cháy.
a) Dựa vào bảng tuần hoàn, hãy trình bày các đặc điểm của nguyên tố phosphorus (ô nguyên tố, chu kì, nhóm, số hiệu nguyên tử, khối lượng nguyên tử, số proton, điện tích hạt nhân).
b) Đọc thông tin ở trên và giải thích vì sao người ta nói “phosphorus là nguyên tố thiết yếu cho cơ thể sống”.
Lời giải:
a) Dựa vào bảng tuần hoàn xác định được:
- Phosphorus ở ô số 15, chu kì 3, nhóm VA.
- Số hiệu nguyên tử P là 15.
- Khối lượng nguyên tử P là 31 amu.
- Số proton của P là 15, điện tích hạt nhân nguyên tử P là +15.
b) Người ta nói “phosphorus là nguyên tố thiết yếu cho cơ thể sống” vì:
- Phosphorus là một trong những thành phần hóa học cấu tạo nên tế bào, được tìm thấy trong chất di truyền, màng tế bào,…
- Phosphorus có vai trò quan trọng trong các hoạt động sống của tế bào như di truyền, hấp thu dinh dưỡng, …
- Trong cơ thể ở động vật có xương sống, cùng với calcium, phosphorus có vai trò quan trọng trong việc hình thành cấu trúc xương.
a) Hãy cho biết các thông tin về nguyên tố silicon trong bảng tuần hoàn.
b) Đọc thông tin ở trên, cho biết vai trò và ứng dụng cơ bản của nguyên tố silicon trong thực tiễn.
Lời giải:
a) Nguyên tố silicon ở ô số 14, chu kì 3, nhóm IVA.
Si có số hiệu nguyên tử là 14; khối lượng nguyên tử là 28 amu; số proton là 14; điện tích hạt nhân là +14.
b) Vai trò và ứng dụng cơ bản của nguyên tố silicon trong thực tiễn:
Silicon siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử để chế tạo các tế bào quang điện, bộ khuếch đại, bộ chỉnh lưu, pin mặt trời, … Silicon dioxide và các muối silicate được sử dụng rộng rãi trong các vật liệu xây dựng như: đất sét, bê tông, cát và xi măng. Nguyên tố này đóng vai trò quan trọng để tạo ra nơ – ron và mô cơ thể, cũng như tham gia vào quá trình tổng hợp vitamin B1 và thamine ở người.
a) Tên nguyên tố, kí hiệu hóa học, số hiệu nguyên tử, khối lượng nguyên tử; nguyên tố kim loại, phi kim hay khí hiếm.
b) Hãy nêu ứng dụng của từng nguyên tố đó (ít nhất hai ứng dụng).
c) Lịch sử phát hiện ra hai nguyên tố đó.
Lời giải:
Lựa chọn 2 nguyên tố hydrogen và oxygen.
a)
- Hydrogen, kí hiệu hóa học là H, số hiệu nguyên tử là 1, khối lượng nguyên tử 1 amu, là nguyên tố phi kim.
- Oxygen, kí hiệu hóa học là O, số hiệu nguyên tử là 8, khối lượng nguyên tử là 16 amu, là nguyên tố phi kim.
b)
- Ứng dụng của hydrogen:
+ Làm nhiên liệu cho động cơ tên lửa, nhiên liệu động cơ ô tô thay thế cho xăng.
+ Dùng làm chất khử để điều chế kim loại từ những oxide của chúng.
+ Dùng để bơm vào khinh khí cầu, bóng thám không.
+ Là nguyên liệu để sản xuất NH3 (amonia) ; HCl (hydrochloric acid) và nhiều hợp chất hữu cơ.
- Ứng dụng của oxygen:
Oxygen có 2 lĩnh vực ứng dụng quan trọng đó là dùng cho sự hô hấp và sự đốt nhiên liệu:
+ Sự hô hấp: Oxygen cần thiết cho sự hô hấp của người và động vật. Không có khí oxygen người và động vật không sống được…
+ Sự đốt nhiên liệu: Oxygen duy trì sự cháy. Các nhiên liệu cháy trong oxygen nguyên chất tạo nhiệt độ cao hơn trong không khí…
c)
- Lịch sử phát hiện ra hydrogen: Lịch sử hóa học ghi nhận rằng hydrogen được tìm ra vào năm 1766 và nhà Vật lí kiêm Hóa học người Anh là H. Cavendish được công nhận là người tìm ra nguyên tố này.
- Lịch sử phát hiện ra oxygen: Oxygen được phát hiện bởi dược sĩ người Thụy Điển Carl Wilhelm Scheele năm 1771 nhưng phát hiện này không được công nhận ngay. Phát hiện độc lập khác của Joseph Priestley vào ngày 1 tháng 8 năm 1774 được biết đến nhiều hơn vì ấn phẩm của Joseph Priestley được xuất bản trước. Oxygen được Antoine Laurent Lavoisier đặt tên năm 1774.
Xem thêm các bài giải SBT Khoa học tự nhiên 7 Cánh diều hay, chi tiết khác:
Bài 4: Phân tử, đơn chất, hợp chất
Bài 5: Giới thiệu về liên kết hóa học
Bài 6: Hóa trị, công thức hóa học
Lý thuyết KHTN 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố hóa học được xếp theo quy luật trong một bảng, gọi là bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn).
- Bảng tuần hoàn hiện nay có 118 nguyên tố hóa học và được xếp theo nguyên tắc sau:
+ Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử.
+ Các nguyên tố trong cùng một cột có tính chất hóa học tương tự nhau.
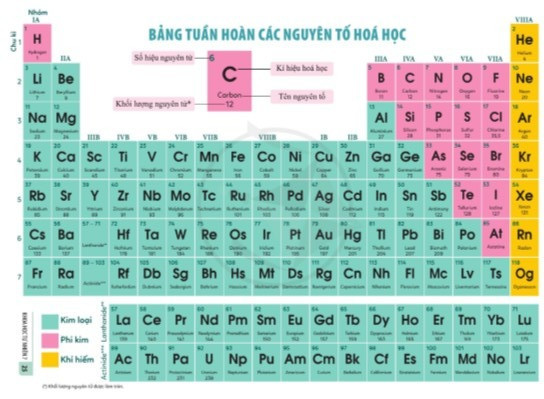
II. Cấu tạo bảng tuần hoàn
Bảng tuần hoàn gồm các ô được sắp xếp thành các hàng và các cột.
1. Ô nguyên tố
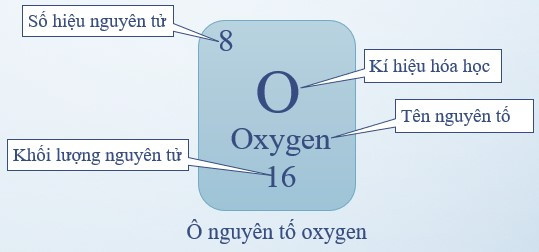
- Ô nguyên tố: là một ô trong bảng tuần hoàn tương ứng với một nguyên tố hóa học.
- Ô nguyên tố cho biết:
+ Số hiệu nguyên tử (kí hiệu là Z): bằng số đơn vị điện tích hạt nhân (bằng số proton và bằng số electron) và là số thứ tự của nguyên tố
+ Kí hiệu hóa học
+ Tên nguyên tố
+ Khối lượng nguyên tử
Ví dụ: Ô nguyên tố oxygen
2. Chu kì
- Chu kì gồm các nguyên tố thuộc cùng nguyên tử có cùng số lớp electron và được sắp xếp thành hàng theo chiều tăng dần của điện tích hạt nhân.
- Số thứ tự của chu kì = số lớp electron của nguyên tố
- Bảng tuần hoàn hiện nay gồm 7 chu kì, được đánh số từ chu kì 1 đến chu kì 7.
- Trong một chu kì, khi đi từ trái qua phải theo chiều tăng dần của điện tích hạt nhân:
+ Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1).
+ Cuối chu kì là một phi kim điển hình (trừ chu kì 7).
+ Kết thúc chu kì là một khí hiếm.
- Ví dụ: Trong chu kì 4:
+ Mở đầu chu kì là nguyên tố potassium (K) – là một kim loại điển hình
+ Cuối chu kì là nguyên tố bromine (Br) – là một phi kim điển hình
+ Kết thúc chu kì là nguyên tố krypton (Kr) – là một khí hiếm
3. Nhóm
- Nhóm gồm các nguyên tố có tính chất hóa học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân.
- Bảng tuần hoàn gồm 18 cột gồm:
+ 8 cột là nhóm A.
+ 10 cột là nhóm B: gọi kà nhóm các nguyên tố kim loại chuyển tiếp (trong phạm vi chương trình chỉ nghiên cứu 8 nhóm A).
- Nhóm A được đánh số bằng số La Mã lần lượt từ nhóm IA đến VIIIA.
- Số thứ tự của nhóm A = số electron lớp ngoài cùng.
Ví dụ:
+ Nhóm IA: gồm các nguyên tố kim loại hoạt động mạnh (kim loại điển hình), trừ hydrogen (H); đều có 1 electron ở lớp ngoài cùng.
+ Nhóm VIIA: gồm các nguyên tố phi kim hoạt động mạnh (phi kim điển hình), trừ tennessine (Ts); đều có 7 electron ở lớp ngoài cùng.
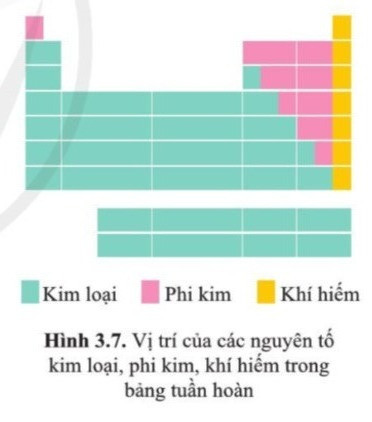
III. Vị trí của các nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
- Các nguyên tố kim loại: (chiếm hơn 80% trong bảng tuần hoàn), nằm bên góc trái và góc dưới bên phải của bảng tuần hoàn.
- Các nguyên tố phi kim: nằm phía trên, bên phải của bảng tuần hoàn. Trong đó, các phi kim hoạt động mạnh nằm ở phía trên.
- Các nguyên tố khí hiếm: Là nguyên tố nằm trong nhóm VIIIA.
IV. Ý nghĩa của bảng tuần hoàn
Bảng tuần hoàn cho biết:
- Các thông tin của một nguyên tố hóa học: tên nguyên tố, số hiệu nguyên tử, kí hiệu hóa học, khối lượng nguyên tử.
- Vị trí của nguyên tố hóa học (ô, chu kì, nhóm). Từ đó nhận ra được các nguyên tố kim loại, phi kim hay khí hiếm:
+ Các nguyên tố ở nhóm IA, IIA, IIIA là kim loại (trừ hydrogen và boron).
+ Hầu hết các nguyên tố ở nhóm VA, VIA, VIIA là phi kim.
+ Các nguyên tố nhóm VIIIA là khí hiếm.
Ví dụ: Bảng tuần hoàn cho biết nguyên tố bromine (Br) ở ô số 35, chu kì 4, nhóm VIIA, là nguyên tố phi kim.