Với giải sách bài tập Khoa học tự nhiên 7 Bài 6: Hóa trị, công thức hóa học sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Khoa học tự nhiên 7. Mời các bạn đón xem:
Giải SBT Khoa học tự nhiên lớp 7 Bài 6: Hóa trị, công thức hóa học
A. nguyên tử hydrogen.
B. nguyên tử oxygen.
C. nguyên tử của nguyên tố khác.
D. nguyên tử helium.
Lời giải:
Đáp án đúng là: C
Hóa trị của một nguyên tố là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử của nguyên tố khác.
Bài 6.2 trang 18 SBT Khoa học tự nhiên 7: Chọn những phát biểu đúng trong các phát biểu dưới đây
a) Mỗi nguyên tố chỉ có một hóa trị trong tất cả các hợp chất.
b) Mọi nguyên tố hóa học đều có từ hai hóa trị trở lên.
c) Hóa trị của H trong mọi hợp chất đều bằng I.
d) Trong các hợp chất, hóa trị của O thường bằng II.
e) Một số nguyên tố chỉ có một hóa trị trong các hợp chất.
Lời giải:
Các phát biểu c, d, e đúng.
Phát biểu a sai vì có những nguyên tố có nhiều hóa trị như S có hóa trị IV trong SO2; hóa trị VI trong SO3 …
Phát biểu b sai vì có nhiều nguyên tố chỉ có 1 hóa trị.
a) Hóa trị của một nguyên tố trong hợp chất cộng hóa trị bằng số electron mà nguyên tử nguyên tố đó đã …. với nguyên tử khác.
b) Nguyên tử của các nguyên tố Li, Na và K đều có 1 electron ở lớp vỏ ngoài cùng, vì vậy các nguyên tố trên có hóa trị …. trong các hợp chất.
c) Nguyên tử của các nguyên tố Mg, Ca và Ba đều có 2 electron ở lớp ngoài cùng, vì vậy các nguyên tố trên có hóa trị …. trong các hợp chất.
d) Trong hydrogen sulfide, một nguyên tử S liên kết với hai nguyên tử H, vậy S có hóa trị …...; còn trong sulfur dioxide, một nguyên tử S liên kết với hai nguyên tử O, vậy S có hóa trị …..
Lời giải:
a) Hóa trị của một nguyên tố trong hợp chất cộng hóa trị bằng số electron mà nguyên tử nguyên tố đó đã góp chung với nguyên tử khác.
b) Nguyên tử của các nguyên tố Li, Na và K đều có 1 electron ở lớp vỏ ngoài cùng, vì vậy các nguyên tố trên có hóa trị I trong các hợp chất.
c) Nguyên tử của các nguyên tố Mg, Ca và Ba đều có 2 electron ở lớp ngoài cùng, vì vậy các nguyên tố trên có hóa trị II trong các hợp chất.
d) Trong hydrogen sulfide, một nguyên tử S liên kết với hai nguyên tử H, vậy S có hóa trị II; còn trong sulfur dioxide, một nguyên tử S liên kết với hai nguyên tử O, vậy S có hóa trị IV.
a) Những nguyên tố hóa học tạo ra chất A.
b) Số lượng nguyên tử của mỗi nguyên tố trong một phân tử chất A.
c) Trong điều kiện thường, chất A ở trạng thái khí, lỏng hay rắn.
d) Chất A là đơn chất hay hợp chất.
e) Chất A tan trong nước hay không tan trong nước.
Lời giải:
Công thức hóa học của của chất A cho biết:
a) Những nguyên tố hóa học tạo ra chất A.
b) Số lượng nguyên tử của mỗi nguyên tố trong một phân tử chất A.
d) Chất A là đơn chất hay hợp chất.
Bài 6.5 trang 19 SBT Khoa học tự nhiên 7:
a) Xác định hóa trị của Ba và Cr trong các hợp chất với O. Biết một nguyên tử Ba liên kết với một nguyên tử O, hai nguyên tử Cr liên kết với ba nguyên tử O.
b) Xác định hóa trị của Al trong hợp chất aluminium hydroxide. Biết một nguyên tử Al liên kết với 3 nhóm (OH).
c) Xác định hóa trị của Cu trong hợp chất copper sulfate. Biết trong hợp chất này, mỗi nguyên tử Cu liên kết với một nhóm (SO4).
Lời giải:
a) Một nguyên tử Ba liên kết với một nguyên tử O nên Ba có hóa trị II,
Hai nguyên tử Cr liên kết với ba nguyên tử O nên Cr có hóa trị III.
b) Một nguyên tử Al liên kết với 3 nhóm (OH), mỗi nhóm (OH) có hóa trị I nên hóa trị của Al là III.
c) Mỗi nguyên tử Cu liên kết với một nhóm (SO4), nhóm (SO4) có hóa trị II nên hóa trị của Cu là II.
a) Ca2+ và Br-
b) O2- và K+
c) Na+ và S2-
d) Fe3+ và Cl-
Lời giải:
a) Đặt công thức hóa học của hợp chất có dạng CaxBry, trong đó Ca có hóa trị II, Br có hóa trị I.
Áp dụng quy tắc hóa trị có:
Chọn x = 1 ; y = 2 ta có công thức hóa học của hợp chất là: CaBr2.
b) Đặt công thức hóa học của hợp chất có dạng KxOy, trong đó K có hóa trị I, còn O có hóa trị II.
Áp dụng quy tắc hóa trị có:
Chọn x = 2; y = 1 ta có công thức hóa học của hợp chất là K2O.
c) Đặt công thức hóa học của hợp chất có dạng NaxSy, trong đó Na có hóa trị I, còn S có hóa trị II.
Áp dụng quy tắc hóa trị có:
Chọn x = 2; y = 1 ta có công thức hóa học của hợp chất là Na2S.
d) Đặt công thức hóa học của hợp chất có dạng FexCly, trong đó Fe có hóa trị III còn Cl có hóa trị I.
Áp dụng quy tắc hóa trị có:
Chọn x = 1; y = 3 ta có công thức hóa học của hợp chất là FeCl3.
Bài 6.7 trang 19 SBT Khoa học tự nhiên 7: Xác định công thức hóa học của:
a) Potassium oxide. Biết K có hóa trị I và khối lượng phân tử của potassium oxide là 94 amu.
b) Copper oxide. Biết Cu có hóa trị II và khối lượng phân tử của copper oxide là 80 amu.
c) Iron oxide. Biết Fe có hóa trị III và khối lượng phân tử của iron oxide là 160 amu.
d) Aluminium sulfide. Biết Al có hóa trị III, S có hóa trị II và khối lượng phân tử của alumium sulfide là 150 amu.
Lời giải:
a) Đặt công thức hóa học của hợp chất có dạng KxOy, trong đó K có hóa trị I, còn O có hóa trị II.
Áp dụng quy tắc hóa trị có:
Chọn x = 2; y = 1 ta có công thức hóa học của hợp chất là K2O.
Có khối lượng phân tử K2O là 39 . 2 + 16 . 1 = 94 amu.
Vậy công thức K2O thỏa mãn.
b) Đặt công thức hóa học của hợp chất có dạng CuxOy, trong đó Cu và O đều có hóa trị II.
Áp dụng quy tắc hóa trị có:
Chọn x = 1; y = 1 ta có công thức hóa học của hợp chất là: CuO.
Có khối lượng phân tử CuO là: 64 . 1 + 16 . 1 = 80 amu.
Vậy công thức CuO thỏa mãn.
c) Đặt công thức hóa học của hợp chất có dạng FexOy, trong đó Fe có hóa trị III còn O có hóa trị II.
Áp dụng quy tắc hóa trị có:
Chọn x = 2; y = 3 ta có công thức hóa học của hợp chất là: Fe2O3.
Có khối lượng phân tử Fe2O3 là: 56 . 2 + 16 . 3 = 160 amu.
Vậy công thức Fe2O3 thỏa mãn.
d) Đặt công thức hóa học của hợp chất có dạng AlxSy, trong đó Al có hóa trị III còn S có hóa trị II.
Áp dụng quy tắc hóa trị có:
Chọn x = 2; y = 3 ta có công thức hóa học của hợp chất là: Al2S3.
Có khối lượng phân tử Al2S3 là: 27 . 2 + 32 . 3 = 150 amu.
Vậy công thức Al2S3 thỏa mãn.
Bài 6.8 trang 19 SBT Khoa học tự nhiên 7: Vitamin C có công thức hóa học là C6H8O6.
a) Vitamin C là đơn chất hay hợp chất?
b) Tính khối lượng phân tử của vitamin C.
c) Tính thành phần phần trăm khối lượng của mỗi nguyên tố trong vitamin C.
Lời giải:
a) Vitamin C là hợp chất vì được tạo thành từ 3 nguyên tố hóa học C, H và O.
b) Khối lượng phân tử của vitamin C là:
6 × 12 + 8 × 1 + 6 × 16 = 176 amu.
c) Thành phần phần trăm khối lượng của mỗi nguyên tố trong vitamin C:
%mO = 100% - %mC - %mH = 100% - 40,91% - 4,55% = 54,54%.
Lời giải:
Đặt công thức phân tử của lactic acid có dạng: CxHyOz.
Khối lượng nguyên tố C trong lactic acid là:
Khối lượng nguyên tố H trong lactic acid là:
Khối lượng nguyên tố O trong lactic acid là:
Ta có: 12 × x = 36 ⇒ x = 3.
1 × y = 6 ⇒ y = 6.
3 × z = 48 ⇒ z = 3.
Vậy công thức hóa học của lactic acid là: C3H6O3.
Lời giải:
Đặt công thức hóa học của hợp chất là AxOy.
A chiếm 70% nên O chiếm 100% - 70% = 30%.
Khối lượng nguyên tố O trong hợp chất là:
Ta có: y × 16 = 48 ⇒ y = 3.
Trong phân tử A có hóa trị III nên:
Lại có y = 3 ⇒ x = 2. Hợp chất là A2O3.
Khối lượng A trong hợp chất là: 160 – 48 = 112
Vậy khối lượng nguyên tử A là:
Nguyên tố A là Fe và công thức hóa học của hợp chất là Fe2O3.
Xem thêm các bài giải SBT Khoa học tự nhiên 7 Cánh diều hay, chi tiết khác:
Bài 5: Giới thiệu về liên kết hóa học
Bài 8: Đồ thị quãng đường - thời gian
Bài 9: Sự truyền âm - thời gian
Lý thuyết KHTN 7 Bài 6: Hóa trị, công thức hóa học
I. Hóa trị
1. Khái niệm về hóa trị
- Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
Ví dụ:
+ Trong phân tử hydrogen chloride, mỗi nguyên tử H và Cl góp chung 1 electron tạo ra đôi electron dùng chung giữa hai nguyên tử nên H và Cl có hóa trị I.
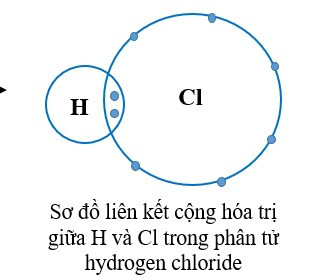
+ Trong phân tử khí carbonic, mỗi nguyên tử O góp chung 2 electron, nguyên tử C góp chung 4 electron. Như vậy nguyên tử C liên kết với 2 nguyên tử O bằng 4 đôi electron chung nên C có hóa trị IV và O có hóa trị II.
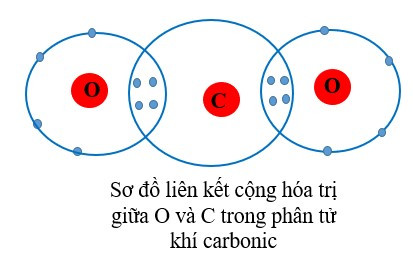
- Thông thường, hóa trị của nguyên tố trong hợp chất cộng hóa trị = số electron mà nguyên tử nguyên tố đó góp chung với nguyên tố khác.
- Trong hợp chất, H luôn có hóa trị I, O luôn có hóa trị II.
- Hóa trị của một số nguyên tố:
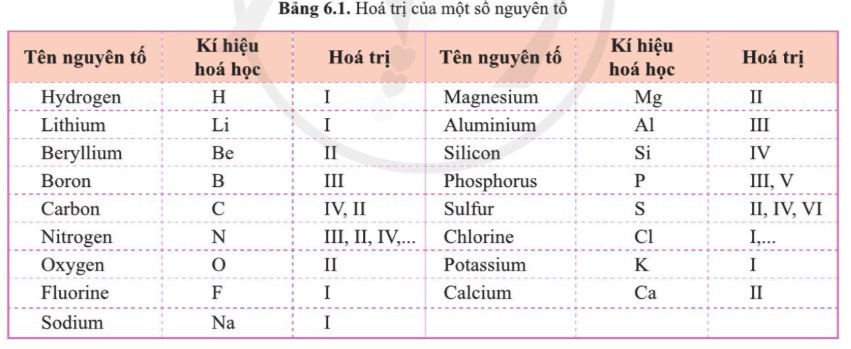
- Hóa trị của một số nhóm nguyên tử

2. Quy tắc hóa trị
- Quy tắc hóa trị: Khi các nguyên tử của hai nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B.
Ví dụ:
+ Trong phân tử nước, hóa trị và số nguyên tử tham gia liên kết của H và O như sau:
|
Nguyên tố |
H |
O |
|
Hóa trị |
I |
II |
|
Số nguyên tử |
2 |
1 |
|
Tích hóa trị và số nguyên tử |
I × 2 = II × 1 |
|
+ Trong phân tử sulfur dioxide (SO2), hóa trị và số nguyên tử tham gia liên kết của S và O như sau:
|
Nguyên tố |
S |
O |
|
Hóa trị |
IV |
II |
|
Số nguyên tử |
1 |
2 |
|
Tích hóa trị và số nguyên tử |
IV × 1 = II × 2 |
|
II. Công thức hóa học
1. Công thức hóa học
- Công thức hóa học dùng để biểu diễn chất.
- Công thức hóa học gồm hai phần:
+ Phần chữ: gồm kí hiệu hóa học của nguyên tố tạo thành chất.
+ Phần số: gồm các số được ghi bên phải, dưới chân kí hiệu hóa học, ứng với số nguyên tử của nguyên tố trong một phân tử (nếu chỉ có một nguyên tử thì không ghi). Các số này được gọi là chỉ số.

- Công thức hóa học của hợp chất có hai kí hiệu hóa học trở lên.
Ví dụ: NaCl, CaO, HNO3, BaSO4,…
- Công thức hóa học của các đơn chất chỉ có một kí hiẹu hóa học.
+ Với phi kim, phân tử thường có hai nguyên tử.
Ví dụ: N2, H2, O2, Br2,…
+ Với kim loại và một số phi kim, kí hiệu hóa học của nguyên tố được coi là công thức hóa học của đơn chất.
Ví dụ: Kim loại: Fe, Cu, Al, Mg,… và phi kim: C, S, P,…
2. Ý nghĩa của công thức hóa học
Công thức hóa học của một số chất cho biết một số thông tin
+ Nguyên tố tạo ra chất.
+ Số nguyên tử của mỗi nguyên tố có trong một phân tử chất.
+ Khối lượng phân tử của chất.
Ví dụ: Công thức hóa học của nitric acid là HNO3:
+ Nitric acid được tạo thành từ H, N và O.
+ Trong một phân tử nitric acid có 1 nguyên tử H, 1 nguyên tử N và 3 nguyên tử O.
+ Khối lượng phân tử của nitric là:
1 × 1 amu + 1 × 14 amu + 3 × 16 amu = 63 amu
Biết công thức hóa học tính được phần trăm khối lượng các nguyên tố trong hợp chất
- Khi biết công thức hóa học của một chất, tính được thành phần phần trăm khối lượng của các nguyên tố tạo ra chất theo các bước sau:
+ Tính khối lượng mỗi nguyên tố có trong một phân tử hợp chất.
+ Tính khối lượng phân tử.
+ Tính phần trăm khối lượng của nguyên tố theo công thức:
(Khối lượng nguyên tố : Khối lượng phân tử hợp chất) × 100%
Ví dụ: Tính phần trăm khối lượng của Cu, O trong hợp chất CuO.
Hướng dẫn giải:
Ta có: Khối lượng của nguyên tố O trong CuO là:
mO = 1 × 16 amu = 16 amu
Khối lượng của nguyên tố Cu trong CuO là:
mCu = 1 × 64 amu = 64 amu
Khối lượng của phân tử CuO là: MCuO = 16 + 64 = 80 (amu)
Phần trăm khối lượng của Cu trong hợp chất CuO là:
Phần trăm về khối lượng của O trong hợp chất CuO là:
%mO = 100% - %mCu = 100% - 80% = 20%
Biết công thức hóa học và hóa trị của một nguyên tố, xác định được hóa trị của nguyên tố còn lại trong hợp chất
- Cách xác định hóa trị khi biết công thức hóa học và hóa trị của một nguyên tố:
+ Đặt hóa trị của nguyên tố chưa biết là a.
+ Xác định a dựa vào quy tắc hóa trị.
Ví dụ: Xác định hóa trị của Al trong hợp chất có công thực hóa học Al2O3.
Giải:
Gọi hóa trị của Al trong hợp chất là a.
Vì O có hóa trị II nên ta có biểu thức: a × 2 = II × 3 → a = III
Vậy Al có hóa trị III trong hợp chất Al2O3.
3. Xác định công thức hóa học của hợp chất khi biết hóa trị hoặc phần trăm khối lượng của các nguyên tố
a) Biết hóa trị của các nguyên tố, lập công thức hóa học của hợp chất tạo thành từ hai nguyên tố
- Nếu hai nguyên tố A, B có hóa trị tương ứng là a, b thì công thức hóa học của hợp chất tạo thành từ A và B được xác định như sau:
+ Đặt công thức hóa học của hợp chất AxBy.
+ Áp dụng quy tắc hóa trị, xác định tỉ lệ
+ Xác định x, y (x, y thường là những số nguyên tố nhỏ nhất thỏa mãn tỉ lệ trên).
Ví dụ: Lập công thức hóa học của hợp chất được tạo bởi S hóa trị IV và O.
Hướng dẫn giải
+ Đặt công thức của hợp chất là SxOy.
+ Theo quy tắc hóa trị: x × IV = y × II
+ Ta có tỉ lệ:
+ Công thức hóa học của hợp chất là: SO2.
b) Xác định công thức hóa học của hợp chất khi biết phần trăm khối lượng của các nguyên tố và khối lượng phân tử của hợp chất
- Khi biết phần trăm khối lượng của hai nguyên tố A, B tạo nên hợp chất và khối lượng phân tử của chất đó, xác định công thức hóa học theo bước sau:
+ Đặt công thức hóa học của hợp chất AxBy.
+ Tính khối lượng của A, B trong một phân tử chất.
+ Tìm x, y.
Ví dụ: R là hợp chất của Fe và O, khối lượng phân tử của R là 72 amu. Biết phần trăm khối lượng của oxygen trong R là 22,22%. Hãy xác định công thức hóa học của R.
Hướng dẫn giải
+ Đặt công thức hóa học của R là FexOy.
+ Khối lượng của nguyên tố O trong một phân tử R là:
+ Khối lượng của nguyên tố S trong một phân tử R là:
72 – 16 = 56 (amu)
+ Ta có: 16 amu × y = 16 amu ⇒ y = 1
56 amu × x = 56 amu ⇒ x = 1
Vậy công thức hóa học của R là FeO.