Với giải sách bài tập Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Khoa học tự nhiên 7. Mời các bạn đón xem:
Giải SBT Khoa học tự nhiên lớp 7 Bài 7: Hóa trị và công thức hóa học
Bài 7.1 trang 22 SBT Khoa học tự nhiên 7: Trong chất cộng hóa trị, phát biểu nào sau đây đúng?
A. Hóa trị của nguyên tố là đại lượng biểu thị khả năng liên kết của nguyên tử nguyên tố đó với nguyên tử nguyên tố khác có trong phân tử.
B. Hóa trị của nguyên tố bằng số H liên kết với nguyên tử nguyên tố đó.
C. Hóa trị của nguyên tố bằng số nguyên tử H và nguyên tử O liên kết với nguyên tố đó.
D. Hóa trị của nguyên tố bằng số nguyên tử O liên kết với nguyên tố đó nhân với 2.
Lời giải:
Đáp án đúng là: A
B đúng khi xét hợp chất với hydrogen.
C đúng khi nguyên tố đang xét liên kết với hydrogen và oxygen.
D đúng khi xét hợp chất với oxygen.
Bài 7.2 trang 22 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Trong hợp chất tạo bởi C và H, hóa trị của nguyên tố C luôn bằng IV vì một nguyên tử C luôn liên kết với 4 nguyên tử H.
B. Trong hợp chất cộng hóa trị, nguyên tố H luôn có hóa trị bằng I.
C. Trong hợp chất, nguyên tố O luôn có hóa trị bằng II.
D. Trong hợp chất, nguyên tố N luôn có hóa trị bằng III.
Lời giải:
Đáp án đúng là: B
A sai, vì có hợp chất một nguyên tử C có thể liên kết với ít hơn 4 nguyên tử H. Ví dụ: CH3Cl…
C sai, vì O có hóa trị khác II trong một số hợp chất như H2O2; Na2O2 …
D sai vì N còn có hóa trị khác III.
Bài 7.3 trang 22 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Công thức hóa học cho biết thành phần nguyên tố và số nguyên tử của chất.
B. Công thức hóa học dùng để biểu diễn chất và cho biết hóa trị của chất.
C. Công thức hóa học dùng để biểu diễn chất và cho biết khối lượng phân tử của chất.
D. Công thức hóa học dùng để biểu diễn các nguyên tố có trong chất.
Lời giải:
Đáp án đúng là: C
A sai vì công thức hóa học cho biết số nguyên tử của mỗi nguyên tố trong một phân tử chất.
B sai vì công thức hóa học không dùng để biểu diễn chất và không có hóa trị của chất.
D sai vì công thức hóa học không dùng để biểu diễn các nguyên tố có trong chất.
Bài 7.4 trang 22 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây không đúng?
A. Công thức hóa học cho biết số nguyên tử của các nguyên tố có trong phân tử của chất.
B. Công thức hóa học dùng để biểu diễn chất và cho biết chất đó là đơn chất hay hợp chất.
C. Công thức hóa học cho ta biết được khối lượng phân tử của chất.
D. Công thức hóa học cho biết được trật tự liên kết giữa các nguyên tử trong phân tử.
Lời giải:
Đáp án đúng là: D
D sai vì, công thức hóa học không cho biết được trật tự liên kết giữa các nguyên tử trong phân tử.
Bài 7.5 trang 22 SBT Khoa học tự nhiên 7: Có các phát biểu sau:
(a) Cách biểu diễn công thức hóa học của kim loại và khí hiếm giống nhau.
(b) Công thức hóa học của các đơn chất phi kim trùng với kí hiệu nguyên tố hóa học.
(c) Dựa vào công thức hóa học, ta luôn xác định được hóa trị của các nguyên tố.
(d) Các chất có cùng khối lượng phân tử thì có cùng công thức hóa học.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: B
Phát biểu (a) và (c) đúng.
Phát biểu (b) sai, ví dụ đơn chất oxygen: O2 còn kí hiệu nguyên tố oxygen là O.
Phát biểu (d) sai, vì có nhiều chất trùng khối lượng phân tử nhưng công thức hóa học khác nhau, ví dụ: carbon dioxide (CO2) và dinitrogen oxide (N2O) đều có cùng khối lượng phân tử là 44 amu.
Bài 7.6 trang 23 SBT Khoa học tự nhiên 7: Có các phát biểu sau:
(a) Trong hợp chất gồm các nguyên tố C, H, O thì O luôn có hóa trị bằng II.
(b) Tùy thuộc vào nguyên tử liên kết với nguyên tố P mà hóa trị của P có thể bằng III và bằng V.
(c) Trong các hợp chất gồm nguyên tố S và nguyên tố O thì S luôn có 1 hóa trị.
(d) Nguyên tố H và nguyên tố Cl đều có hóa trị bằng I trong các hợp chất.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: B
Các phát biểu (a) và (b) đúng.
Phát biểu (c) sai vì trong hợp chất của S với O thì S có thể có hóa trị IV (trong SO2) hoặc VI (trong SO3).
Phát biểu (d) sai vì Cl là nguyên tố có nhiều hóa trị.
Bài 7.7 trang 23 SBT Khoa học tự nhiên 7: Có các phát biểu sau:
(a) Công thức hóa học của kim loại trùng với kí hiệu nguyên tố vì mỗi phân tử kim loại chỉ gồm 1 nguyên tử kim loại.
(b) Các nguyên tố khí hiếm không kết hợp với nguyên tố khác hoặc với chính nó vì chúng trơ về mặt hóa học. Do đó, công thức hóa học của nó trùng với kí hiệu nguyên tố.
(c) Nguyên tố oxygen thường xếp cuối công thức hóa học.
(d) Nguyên tố kim loại luôn xếp ở đầu công thức hóa học.
(e) Trong công thức hóa học, tỉ lệ số nguyên tử của các nguyên tố bằng tỉ lệ hóa trị của các nguyên tố tương ứng.
Số phát biểu không đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: D
Chỉ có phát biểu (c) đúng.
Phát biểu (a) sai vì: Đối với đơn chất kim loại, hạt hợp thành là nguyên tử nên kí hiệu hóa học của nguyên tố kim loại được coi là công thức hóa học của đơn chất kim loại.
Phát biểu (b) sai vì: Trong một số trường hợp đặc biệt khí hiếm vẫn có thể tham gia phản ứng hóa học.
Phát biểu (d) sai vì: Một số trường hợp nguyên tố kim loại xếp ở cuối công thức hóa học như CH3COONa, C2H5ONa…
Phát biểu (e) sai vì: Trong công thức hóa học, tỉ lệ số nguyên tử của các nguyên tố bằng nghịch đảo tỉ lệ hóa trị của các nguyên tố tương ứng.
a) Trong chất cộng hóa trị, nguyên tố H luôn có (1) …, nguyên tố O thường có (2)….
b) Trong hợp chất, nguyên tố P có hóa trị (3) …. Nguyên tố N có hóa trị (4) ….
Lời giải:
a) Trong chất cộng hóa trị, nguyên tố H luôn có (1) hóa trị I, nguyên tố O thường có (2) hóa trị II.
b) Trong hợp chất, nguyên tố P có hóa trị (3) III hoặc V. Nguyên tố N có hóa trị (4) II, III, IV …
Bài 7.9 trang 23 SBT Khoa học tự nhiên 7: Trong các nguyên tố sau: H, N, O, C, S, Na, Mg, Al, Fe
a) Nguyên tố nào có nhiều hóa trị trong hợp chất? Cho ví dụ.
b) Nguyên tố nào có hóa trị cao nhất? Cho ví dụ.
Lời giải:
a) Nguyên tố có nhiều hóa trị trong hợp chất là N, O, C, S, Fe.
Ví dụ:
+ N có hóa trị IV trong nitrogen dioxide (NO2), có hóa trị III trong ammonia (NH3).
+ O có hóa trị II trong nhiều hợp chất, có hóa trị I trong hydrogen peroxide (H2O2).
+ C có hóa trị II trong hợp chất carbon monoxide (CO), có hóa trị IV trong hợp chất carbon dioxide (CO2).
+ S có hóa trị IV trong hợp chất sulfur dioxide (SO2), có hóa trị VI trong hợp chất sulfur trioxide (SO3).
+ Fe có hóa trị II trong iron(II) oxide (FeO), có hóa trị III trong iron(III) oxide (Fe2O3).
b) Nguyên tố có hóa trị cao nhất là S, ví dụ trong hợp chất sulfur trioxide, S có hóa trị VI.
a) Công thức hóa học dùng để (1) …. Công thức hóa học cho biết (2) …
b) Công thức hóa học chung của phân tử có dạng (3) …. Từ % nguyên tố và khối lượng phân tử, ta luôn (4) …
Lời giải:
a) Công thức hóa học dùng để (1) biểu diễn chất, gồm một hoặc nhiều kí hiệu nguyên tố và chỉ số ghi ở phía dưới, bên phải kí hiệu. Công thức hóa học cho biết (2) một phân tử được cấu tạo từ những nguyên tố nào, số lượng mỗi nguyên tố có trong phân tử đó. Từ đó, có thể tính được khối lượng phân tử.
b) Công thức hóa học chung của phân tử có dạng (3) AxBy. Từ % nguyên tố và khối lượng phân tử, ta luôn (4) tìm được công thức hóa học của chất.
a) Từ quy tắc hóa trị, ta rút ra được tỉ lệ số nguyên tử bằng (1) …. Khi biết tỉ lệ số nguyên tử, ta (2) …
b) Công thức hóa học của kim loại và khí hiếm (3) …. Đơn chất phi kim có công thức hóa học (4) …
Lời giải:
a) Từ quy tắc hóa trị, ta rút ra được tỉ lệ số nguyên tử bằng (1) nghịch đảo của tỉ lệ hóa trị tương ứng. Khi biết tỉ lệ số nguyên tử, ta (2) suy ra được công thức hóa học.
b) Công thức hóa học của kim loại và khí hiếm (3) trùng với kí hiệu nguyên tố. Đơn chất phi kim có công thức hóa học (4) là nguyên tử hoặc phân tử.
Lời giải:
S có hóa trị VI và O có hóa trị II.
Công thức hóa học chung: SxOy
Theo quy tắc hóa trị ta có: x . VI = y. II
Chọn x = 1; y = 3. Vậy công thức hóa học của hợp chất là SO3.
Lời giải:
Ca có hóa trị II, nhóm (PO4) có hóa trị III.
Công thức hóa học chung của hợp chất: Cax(PO4)y
Theo quy tắc hóa trị, ta có: x . II = y . III
Chọn x = 3; y = 2. Vậy công thức hóa học của hợp chất là Ca3(PO4)2.
Khối lượng phân tử của hợp chất là: 40 . 3 + (31 + 16 . 4). 3 = 310 amu.

a) Hãy các định công thức hóa học của các hợp chất này và tính khối lượng phân tử của chúng.
b) Trong phân tử của các hợp chất trên có chứa loại liên kết hóa học gì?
Lời giải:
a) Ta có hóa trị của C và S trong hợp chất cần xác định là IV.
Công thức hóa học chung: MxOy (với M là nguyên tố đại diện cho C, S và O có hóa trị II).
Theo quy tắc hóa trị ta có: x . IV = y . II
Chuyển về tỉ lệ:
Chọn x = 1, y = 2. Vậy công thức hóa học của các hợp chất này là CO2; SO2.
Khối lượng phân tử CO2 bằng: 12 + 16 . 2 = 44 (amu).
Khối lượng phân tử SO2 bằng: 32 + 16 . 2 = 64 (amu).
b) Liên kết trong các phân tử CO2, SO2 là liên kết cộng hóa trị do các hợp chất này đều ở thể khí và đều được cấu tạo từ các nguyên tố phi kim.
Lời giải:
M có hóa trị VI; O có hóa trị II.
Gọi công thức hóa học chung của E là: MxOy.
Theo quy tắc hóa trị ta có: x . VI = y. II
Chuyển về tỉ lệ:
Chọn x = 1; y = 3. Vậy công thức hóa học của hợp chất E là MO3.
Lại có: KLPT (MO3) = KLNT(M) + 16 . 3 = 80 amu
⇒ KLNT (M) = 32 amn. Vậy M là S.
Công thức hóa học của hợp chất E là SO3.

a) Hãy các định công thức hóa học của hợp chất ammonium carbonnate.
b) Tính phần trăm (%) của nguyên tố N trong hợp chất trên.
Lời giải:
a) Công thức hóa học chung:
Theo quy tắc hóa trị, ta có: I . x = II . y
Chuyển về tỉ lệ:
Chọn x = 2; y = 1. Vậy công thức hóa học của hợp chất là (NH4)2CO3.
b) Trong (NH4)2CO3 có:

Thành phần chính của bột thạch cao là hợp chất (G) gồm calcium và gốc sulfate.
a) Xác định công thức hóa học của hợp chất (G).
b) Hãy cho biết trong phân tử hợp chất (G), nguyên tố nào có phần trăm (%) lớn nhất.
Lời giải:
a) Công thức hóa học chung của hợp chất G:
Theo quy tắc hóa trị, ta có: II . x = II . y
Chuyển về tỉ lệ:
Chọn x = 1; y = 1. Vậy công thức hóa học của hợp chất là CaSO4.
b) Trong CaSO4 có:
%O = 100% - %Ca - %S = 100% - 29,41% - 23,53% = 47,06%.
Vậy trong CaSO4, nguyên tố O có phần trăm lớn nhất.
Lời giải:
Theo đề bài ta có:
KLPT (XOn) = KLNT (X) + 16 × n = 46 amu (1)
Mặt khác trong XOn có:
(2)
Thay KLNT (X) vào (1) được n = 2.
Vậy công thức của oxide là NO2.
Lời giải:
Công thức hóa học chung của (Y) là MCln (vì M có hóa trị n; Cl hóa trị I).
Theo đề bài ta có:
KLPT (MCln) = KLNT (X) + 35,5.n = 135 amu (1)
Lại có:
Thay (2) vào (1) được n = 2. Vậy công thức hóa học của Y là CuCl2.

Trong hợp chất (Z) có 46,67% iron, còn lại là sulfur.
a) Xác định công thức hóa học của hợp chất (Z).
b) Tìm hiểu trên internet, em hãy cho biết tên gọi và một số ứng dụng của (Z).
Lời giải:
a) Gọi công thức hợp chất (Z) là FexSy, ta có:
Từ (1) và (2), ta có:
Chọn x = 1, y = 2. Vậy công thức hóa học của hợp chất Z là FeS2.
b) FeS2 có tên gọi là pirit sắt hay iron pyrite.
Hợp chất này được sử dụng trong sản xuất sulfur dioxide; sulfuric acid.
Xem thêm các bài giải SBT Khoa học tự nhiên lớp 7 Chân trời sáng tạo hay, chi tiết khác:
Bài 6: Giới thiệu về liên kết hóa học
Bài 7: Hóa trị và công thức hóa học
Bài 9: Đồ thị quãng đường - thời gian
Lý thuyết KHTN 7 Bài 7: Hóa trị và công thức hóa học
I. Hóa trị
1. Định nghĩa
- Hóa trị của một nguyên tố trong hợp chất là con số biểu thị khả năng liên kết của nguyên tử nguyên tố đó với nguyên tử khác trong phân tử.
- Hóa trị được biểu thị bằng các chữ số La Mã (I; II …)
2. Cách xác định
- Để xác định hóa trị của nguyên tố trong hợp chất cộng hóa trị, người ta dựa vào hóa trị của nguyên tố đã biết làm đơn vị, chẳng hạn hóa trị của H là I; hóa trị của O là II.
Ví dụ 1: Trong phân tử phosphine (PH3) một nguyên tử P có khả năng liên kết với 3 nguyên tử H, mỗi nguyên tử H có hóa trị I ⇒ P có hóa trị III
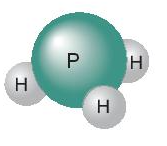
Ví dụ 2: Trong phân tử silicon dioxide (SiO2), 1 nguyên tử Si có khả năng liên kết với 2 nguyên tử O, mỗi nguyên tử O hóa trị II ⇒ Si có hóa trị IV.
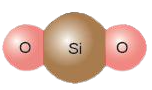
II. Quy tắc hóa trị
- Quy tắc hóa trị: Trong phân tử hợp chất hai nguyên tố, tích hóa trị và số nguyên tử của nguyên tố này bằng tích hóa trị và số nguyên tử của nguyên tố kia.
- Ví dụ: Trong phân tử aluminium chlorine (AlCl3), hóa trị và số nguyên tử tham gia liên kết của Al và Cl như sau:
|
Nguyên tố |
Al |
Cl |
|
Hóa trị |
III |
I |
|
Số nguyên tử |
1 |
3 |
|
Tích hóa trị và số nguyên tử |
III × 1 = I × 3 |
|
III. Công thức hóa học
Phân tử của chất được tạo thành từ nguyên tử của một hay nhiều nguyên tố và được biểu diễn bằng công thức hóa học.
1. Viết công thức hóa học của đơn chất
- Công thức hóa học của đơn chất được kí hiệu bằng kí hiệu nguyên tố hóa học kèm với chỉ số (chỉ số nguyên tử của mỗi nguyên tố trong một phân tử) ghi ở bên dưới.
- Một số đơn chất phi kim thể khí (ở điều kiện thường) có công thức hóa học chung là Ax.
Ví dụ: Phân tử khí oxygen được tạo thành từ hai nguyên tử oxygen liên kết với nhau, công thức phân tử của khí oxygen là O2.
- Đối với đơn chất kim loại, hạt hợp thành là nguyên tử nên kí hiệu hóa học của nguyên tố kim loại được coi là công thức hóa học của đơn chất kim loại.
Ví dụ: Kim loại iron có công thức hóa học là Fe.
- Một số đơn chất phi kim ở thể rắn, quy ước công thức hóa học là kí hiệu nguyên tố.
Ví dụ: Công thức hóa học của đơn chất phosphorus là P.
Chú ý:
- Nếu chỉ số trong công thức hóa học bằng 1 thì quy ước không ghi.
- Trong hợp chất gồm oxygen và nguyên tố khác, nguyên tố oxygen thường ghi ở cuối công thức hóa học.
2. Viết công thức hóa học của hợp chất
- Công thức hóa học của hợp chất gồm kí hiệu hóa học của những nguyên tố tạo thành kèm chỉ số ở bên dưới mỗi kí hiệu.
- Công thức chung của phân tử có dạng: AxBy
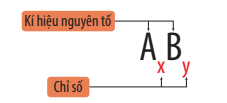
Ví dụ: Phân tử carbon dioxide gồm 1 nguyên tử carbon và 2 nguyên tử oxygen, công thức hóa học của phân tử carbon dioxide là CO2.
- Công thức hóa học cho biết thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố có trong phân tử đó. Từ đó, có thể tính được khối lượng phân tử.
Chú ý: Cách viết công thức hóa học hợp chất
- Hợp chất tạo bởi oxygen và nguyên tố khác, công thức hóa học có dạng AxOy.
- Nếu A là kim loại và B là phi kim, công thức hóa học có dạng AxBy.
- Hợp chất tạo bởi hydrogen và nguyên tố A:
+ Nếu A thuộc các nhóm IA đến VA, công thức hóa học có dạng AHx.
+ Nếu A thuộc các nhóm VIA đến VIIA, công thức hóa học có dạng HxA.
IV. Tính phần trăm nguyên tố trong hợp chất
- Phần trăm (%) nguyên tố trong hợp chất được tính bằng tỉ số giữa khối lượng của nguyên tố đó trong một phân tử hợp chất và khối lượng phân tử (KLPT) của hợp chất.
- Khối lượng của nguyên tố trong một phân tử hợp chất được tính bằng tích của khối lượng nguyên tử (KLNT) và số nguyên tử của nguyên tố đó.
- Tổng quát:
+ Với hợp chất AxBy, ta có:
+ Tổng tất cả các phần trăm nguyên tố trong một phân tử luôn bằng 100%.
- Ví dụ: Đối với hợp chất MgCl2
%Mg = = = 25,26%
%O = 100% - 25,26% = 74,74%
V. Xác định công thức hóa học
1. Xác định công thức hóa học khi biết phần trăm nguyên tố và khối lượng phân tử
- Các bước xác định:
Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát);
Bước 2: Lập biểu thức tính phần trăm nguyên tố có trong hợp chất;
Bước 3: Xác định số nguyên tử của mỗi nguyên tố và viết công thức hóa học cần tìm.
- Ví dụ: Thạch nhũ trong hang động có thành phần chính là hợp chất (T). Phân tử (T) có cấu tạo từ nguyên tố calcium, carbon và oxygen với các tỉ lệ phần trăm tương ứng là 40%, 12% và 48%. Khối lượng phân tử (T) là 100 amu. Hãy xác định công thức hóa học của (T).
Hướng dẫn giải:
Đặt công thức hóa học của hợp chất (T) là: CaxCyOz
%Ca = = 40%
⇒ x = 1
%C = = 12%
⇒ y = 1
%O = = 48%
⇒ z = 3
Vậy công thức hóa học của hợp chất là CaCO3
2. Xác định công thức hóa học dựa vào quy tắc hóa trị
- Các bước xác định:
+ Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát)
+ Bước 2: Lập biểu thức tính dựa vào quy tắc hóa trị, chuyển thành tỉ lệ các chỉ số nguyên tử.
+ Bước 3: Xác định số nguyên tử (những số nguyên đơn giản nhất, có tỉ lệ tối giản) và viết công thức hóa học cần tìm.
- Ví dụ: Hợp chất tạo bởi oxygen và phosphorus có dạng:
Theo quy tắc hóa trị ta có: x × V = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 5
Vậy công thức hóa học của hợp chất là P2O5
Chú ý:
- Quy tắc hóa trị thường đúng với đa số hợp chất vô cơ. Tuy nhiên, quy tắc này không đúng với đa số hợp chất hữu cơ (C2H4; C6H6 …) và một số hợp chất vô cơ (H2O2; Na2O2 …)