Với giải sách bài tập Khoa học tự nhiên 8 Bài 11: Muối hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Khoa học tự nhiên 8. Mời các bạn đón xem:
Giải SBT Khoa học tự nhiên 8 Bài 11: Muối
A. Muối.
B. Acid.
C. Base.
D. Oxide.
Lời giải:
Đáp án đúng là: A
X là muối.
Bài 11.2 trang 33 Sách bài tập KHTN 8: Phản ứng nào sau đây không tạo ra muối?
A. Acid tác dụng với base.
B. Kim loại tác dụng với oxygen.
C. Acid tác dụng với oxide base.
D. Base tác dụng với oxide acid.
Lời giải:
Đáp án đúng là: B
Kim loại tác dụng với oxygen sinh ra oxide.
Bài 11.3 trang 33 Sách bài tập KHTN 8: Cho sơ đồ phản ứng sau:
? + 2HCl → ZnCl2 + H2
Chất thích hợp để điền vào vị trí dấu hỏi là
A. Zn(OH)2. B. ZnO. C. Zn. D. ZnCO3.
Lời giải:
Đáp án đúng là: C
Zn + 2HCl → ZnCl2 + H2
Bài 11.4 trang 33 Sách bài tập KHTN 8: Chất nào sau đây thuộc loại muối?
A. Ca(OH)2. B. Al2O3. C. H2SO4. D. MgCl2.
Lời giải:
Đáp án đúng là: D
Chất thuộc loại muối là: MgCl2.
A. 1. B. 2. C. 3. D. 4.
Lời giải:
Đáp án đúng là: C
Số chất thuộc loại muối là 3 chất gồm: KCl; MgSO4; NaNO3.
Bài 11.6 trang 33 Sách bài tập KHTN 8: Cho sơ đồ phản ứng sau:
CuO + H2SO4 → ? + H2O
Ở vị trí dấu hỏi (?) là công thức nào sau đây?
A. CuS.
B. CuSO4.
C. Cu2(SO4).
D. SO2.
Lời giải:
Đáp án đúng là: B
CuO + H2SO4 → CuSO4 + H2O
Bài 11.7 trang 33 Sách bài tập KHTN 8: Cho sơ đồ phản ứng sau:
CO2 + NaOH → ? + H2O
Chất ở vị trí dấu hỏi (?) có tên gọi là
A. sodium carbonate.
B. sodium sulfate.
C. potassium carbonate.
D. potassium sulfate.
Lời giải:
Đáp án đúng là: A
CO2 + 2NaOH → Na2CO3 + H2O
Trong đó: Na2CO3: sodium carbonate.
Bài 11.8 trang 33 Sách bài tập KHTN 8: Các muối nào sau đây đều tan tốt trong nước?
A. Na2SO4, BaSO4, BaCl2.
B. CuSO4, FeCl3, Pb(NO3)2.
C. MgSO4, ZnSO4, PbSO4.
D. K2CO3, CaCO3, CaCl2.
Lời giải:
Đáo án đúng là: B
Các muối CuSO4, FeCl3, Pb(NO3)2 đều tan trong nước.
Bài 11.9 trang 34 Sách bài tập KHTN 8: Cho sơ đồ phản ứng sau:
Zn + CuSO4 → ZnSO4 + ?
Chất thích hợp để điền vào vị trí dấu hỏi (?) là
A. Cu(OH)2.
B. ZnO.
C. Cu.
D. CuO.
Lời giải:
Đáp án đúng là: C
Zn + CuSO4 → ZnSO4 + Cu
Bài 11.10 trang 34 Sách bài tập KHTN 8: Cho sơ đồ phản ứng sau:
? + H2SO4 → Na2SO4 + CO2 + H2O
Chất thích hợp để điền vào vị trí dấu hỏi (?) là
A. NaOH. B. Na2O.
C. CaCO3. D. Na2CO3.
Lời giải:
Đáp án đúng là: D
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
Bài 11.11 trang 34 Sách bài tập KHTN 8: Cho sơ đồ phản ứng sau:
MgSO4 + ? → Mg(OH)2 + Na2SO4
Chất thích hợp để điền vào vị trí dấu hỏi (?) là
A. NaOH. B. Na2O.
C. Ca(OH)2. D. Na.
Lời giải:
Đáp án đúng là: A
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4
Bài 11.12 trang 34 Sách bài tập KHTN 8: Cho sơ đồ phản ứng sau:
K2SO4 + ? → 2KCl + BaSO4
Chất thích hợp để điền vào vị trí dấu hỏi (?) là
A. HCl. B. BaCl2. C. Ba(OH)2. D. BaO.
Lời giải:
Đáp án đúng là: B
K2SO4 + BaCl2 → 2KCl + BaSO4
A. NaOH. B. CaCl2. C. AgNO3. D. Na2SO4.
Lời giải:
Đáp án đúng là: C
AgNO3 + HCl → AgCl↓ + HNO3
A. KOH. B. CaCl2. C. AgNO3. D. Na2SO3.
Lời giải:
Đáp án đúng là: D
Na2SO3 + H2SO4 → Na2SO4 + SO2↑ + H2O
A. FeCl3.
B. BaCl2.
C. NaNO3.
D. K2SO4.
Lời giải:
Đáp án đúng là: A
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
A. Fe2(SO4)3.
B. Na2SO4.
C. MgSO4.
D. CaSO3.
Lời giải:
Đáp án đúng là: C
M có hoá trị II nên muối sulfate có công thức MSO4.
Tỉ lệ của M là:
Vậy M là Mg, muối là MgSO4.
A. 20 g. B. 15,4 g. C. 24,8 g. D. 15,2 g.
Lời giải:
Đáp án đúng là: D
Phương trình hoá học:
Fe + H2SO4 → FeSO4 + H2
0,1 → 0,1 mol
Khối lượng FeSO4 là: 0,1.152 = 15,2 gam.
A. 6,4g.
B. 6,5g.
C.16g.
D. 3,2g.
Lời giải:
Đáp án đúng là: A
Zn + CuSO4 → ZnSO4 + Cu
0,1 → 0,1 mol
Khối lượng Cu sinh ra là: mCu = 0,1.64 = 6,4 gam.
A. 9,8g. B. 33,1g. C. 23,3g. D. 31,3g.
Lời giải:
Đáp án đúng là: B
CuSO4 + Ba(OH)2 → Cu(OH)2↓ + BaSO4↓
0,1 → 0,1 0,1 mol
Kết tủa sau phản ứng gồm: Cu(OH)2 0,1 mol và BaSO4 0,1 mol
Khối lượng kết tủa thu được sau phản ứng là: 0,1.98 + 0,1.233 = 33,1 gam.
a) Có bao nhiêu chất thuộc loại muối?
b) Có bao nhiêu muối tan?
Lời giải:
a) Có 5 chất thuộc loại muối: (NH4)2SO4, AgCl, CuCl2, Ba(NO3)2, Al2(SO4)3.
b) Có 4 muối tan: (NH4)2SO4, CuCl2, Ba(NO3)2, Al2(SO4)3.
Bài 11.21 trang 35 Sách bài tập KHTN 8: Cho các muối sau: Na2SO4, BaCl2, AgNO3, K2CO3.
a) Gọi tên các muối trên.
b) Viết PTHH của phản ứng giữa các muối trên trong dung dịch (nếu có).
Lời giải:
a) Gọi tên các muối:
Na2SO4: sodium sulfate;
BaCl2: barium chloride;
AgNO3: silver nitrate;
K2CO3: potassium carbonate.
b) Các PTHH của phản ứng giữa các muối trên trong dung dịch:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
Na2SO4 + 2AgNO3 → Ag2SO4↓ + 2NaNO3
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
BaCl2 + K2CO3 → BaCO3↓ + 2KCl
2AgNO3 + K2CO3 → Ag2O↓ + CO2↑ + 2KNO3
Bài 11.22 trang 35 Sách bài tập KHTN 8: Hãy viết công thức và gọi tên:
a) 5 muối tan.
b) 3 muối không tan.
Lời giải:
a) 5 muối tan:
NaCl: sodium chloride;
KCl: potassium chloride;
NaNO3: sodium nitrate;
K2SO4: potassium sulfate;
Mg(NO3)2: magnesium nitrate.
b) 3 muối không tan:
BaCO3: barium carbonate;
BaSO4: barium sulfate;
MgCO3: magnesium carbonate.
Bài 11.23 trang 35 Sách bài tập KHTN 8: Hoàn thành các PTHH sau:
(1) ? + AgNO3 → Cu(NO3)2 + Ag
(2) NaOH + ? → Al(OH)3 + Na2SO4
(3) ? + ? → KCl + SO2 + H2O
(4) BaCl2 + AgNO3 → ? + ?
Giải thích vì sao các phản ứng trên có thể xảy ra.
Lời giải:
Hoàn thành các phản ứng:
(1) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
(2) 6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4
(3) K2SO3 + 2HCl → 2KCl + SO2↑ + H2O
(4) BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
Các phản ứng trên có thể xảy ra do sau phản ứng tạo thành chất không tan hoặc chất khí …
Bài 11.24 trang 35 Sách bài tập KHTN 8: Cho sơ đồ phản ứng:
Muối X + muối Y → muối Z + muối T.
Hãy tìm các cặp X, Y nếu:
a) X là muối chloride, Y là muối nitrate.
b) X là muối của barium, Y là muối của sodium.
Lời giải:
a) X là muối NaCl, Y là muối AgNO3.
NaCl + AgNO3 → AgCl↓ + NaNO3
b) X là muối Ba(NO3)2, Y là muối Na2SO4.
Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3
Lời giải:
Fe + CuSO4 → FeSO4 + Cu
Số mol Fe phản ứng = số mol CuSO4 = 0,2a mol = số mol Cu tạo thành.
Khối lượng tăng thêm = khối lượng Cu - khối lượng Fe.
= 64. 0,2a – 56. 0,2a = 0,8 (g).
Vậy a = 0,5.
a) Xác định nồng độ ban đầu của dung dịch Na2CO3.
b) Nhúng giấy quỳ tím vào dung dịch sau phản ứng, giấy quỳ đổi thành màu gì?
Lời giải:
a) Na2CO3 + 2HCl→ 2NaCl + CO2 + H2O
Số mol HCl = 0,2 mol; số mol CO2 = = 0,08 mol
Số mol HCl phản ứng = 2. = 0,16 (mol).
Vậy HCl dư, Na2CO3 hết, số mol Na2CO3 = số mol CO2 = 0,08 mol.
Nồng độ ban đầu của dung dịch Na2CO3: = 0,8 (M).
b) Nhúng giấy quỳ tím vào dung dịch sau phản ứng, giấy quỳ đổi thành màu đỏ.
a) Xác định kim loại M và công thức muối chloride.
b) Tính nồng độ của dung dịch NaOH đã dùng.
Lời giải:
a) M hoá trị n, muối có công thức MCln; số mol muối là a mol.
MCln + nNaOH → M(OH)n + nNaCl
a na a na mol
Ta có:
Khối lượng muối là 32,5 gam nên: a(M + 35,5n) = 32,5 (1)
Khối lượng kết tủa là 21,4 gam nên: a(M + 17n) = 21,4 (2)
Từ (1) và (2) ta có:
Vậy n = 3; M = 56 thoả mãn.
Kim loại M là Fe, muối là FeCl3.
b) Số mol NaOH = n.a = 3.0,2 = 0,6 mol
Nồng độ dung dịch NaOH đã dùng: = 2(M).
a) Xác định khối lượng mỗi chất trong hỗn hợp X.
b) Tính khối lượng muối chloride thu được.
Lời giải:
= 0,15 (mol).
Gọi số mol CaCO3 và MgCO3 trong X lần lượt là a và b (mol).
Phương trình hoá học:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
a a a mol
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
b b b mol
a) Theo bài ra:
mX = 14,2 gam nên 100a + 84b = 14,2 (1)
Theo phương trình hoá học: = a + b = 0,15 (2)
Từ (1) và (2) giải phương trình ta được: a = 0,1 và b = 0,05.
Khối lượng CaCO3 trong X: 0,1.100 = 10 gam.
Khối lượng MgCO3 trong X: 14,2 – 10 = 4,2 gam.
b)
Theo phương trình hoá học:
Tổng khối lượng muối chloride thu được là: 11,1 + 4,75 = 15,85 gam.
Lời giải:
Gọi số mol NaCl = Số mol KCl = a mol.
Phương trình hoá học:
NaCl + AgNO3 → AgCl↓ + NaNO3
a a mol
KCl + AgNO3 → AgCl↓ + KNO3
a a mol
Theo phương trình hoá học có tổng số mol kết tủa là a + a = 2a mol.
Khối lượng kết tủa là 8,61 gam nên: 2a.143,5 = 8,61 hay a = 0,03.
Khối lượng hỗn hợp Y là: m = 0,03.58,5 + 0,03.74,5 = 3,99 gam.
Soda có khả năng làm mềm nước cứng do soda có phản ứng tạo kết tủa với các ion Ca2+ và Mg2+. Soda còn có tác dụng điều chỉnh độ pH cho nước trong hồ bơi, tạo môi trường để các loại rong, rêu, tảo không thể phát triển, gây ô nhiễm nguồn nước.
a) Viết PTHH của phản ứng xảy ra khi cho soda vào nước cứng có chứa CaCl2 và MgCl2. Từ đó giải thích vì sao soda lại dùng để xử lí nước cứng.
b) Viết PTHH của phản ứng xảy ra khi cho soda vào dung dịch HCl. Từ đó giải thích vì sao soda có tác dụng điều chỉnh pH của nước hồ bơi.
c) Em hãy nêu một số ứng dụng khác của soda và tìm hiểu thêm tác hại và lợi ích của nước cứng.
d) Trong các câu sau đây, câu nào đúng, câu nào sai?
1. CO2 thuộc loại oxide base.
2. Soda phản ứng hoàn toàn với nước tạo NaOH và CO2.
3. Để bảo quản soda nên cho soda vào các túi nilon kín, không dùng túi giấy.
4. Nước cứng có môi trường acid.
Lời giải:
a) Phương trình hoá học:
Na2CO3 + CaCl2 → CaCO3 ↓ + 2NaCl
Na2CO3 + MgCl2→ MgCO3↓ + 2NaCl
Các phản ứng trên đã làm kết tủa ion Ca2+ và Mg2+ tách ra khỏi nước nên có thể làm mềm nước cứng.
b) Na2CO3 + 2HCl→ 2NaCl + H2O + CO2↑
Phản ứng trên đã trung hoà ion H+, làm giảm tính acid của dung dịch do đó soda được dùng để điều chỉnh pH nước hồ bơi.
c) Ứng dụng của soda: sản xuất thuỷ tinh, xà phòng, chất tẩy rửa,... và trong chế biến thực phẩm, dược phẩm,...
Nước cứng có các tác hại như: làm giảm khẩu vị trong nấu ăn, pha trà; quần áo, vải sợi nhanh bị mục nát khi giặt bằng xà phòng trong nước cứng ... nhưng cũng có tác dụng cung cấp nguồn vi lượng khoáng.
d) 1 - sai; 2 - sai; 3 - đúng; 4 - sai.
Xem thêm các bài giải SBT Khoa học tự nhiên 8 Kết nối tri thức hay, chi tiết khác:
Bài 14: Thực hành xác định khối lượng riêng
Bài 15: Áp suất trên một bề mặt
Lý thuyết KHTN 8 Bài 11: Muối
I. Khái niệm
- Phản ứng tạo muối là quá trình tạo ra muối từ sự kết hợp giữa cation kim loại và anion gốc acid thông qua phản ứng giữa acid và kim loại hoặc oxide base.
- Các phản ứng tạo muối trong bảng 11.1 đều có thành phần phân tử gồm cation kim loại và anion gốc acid.
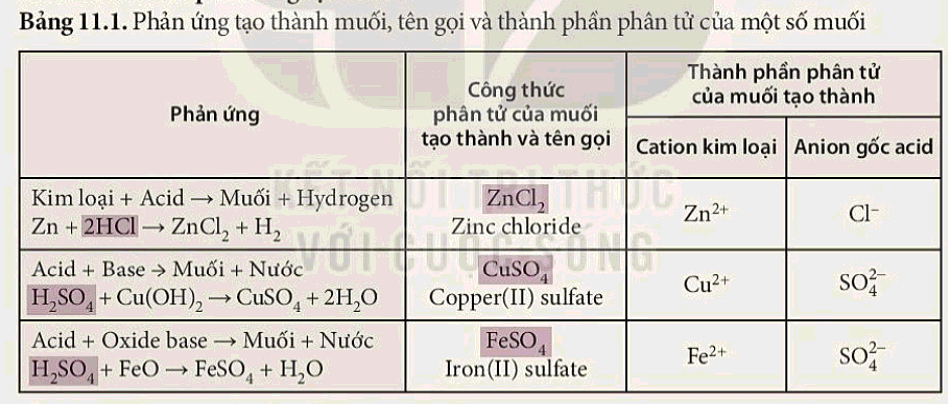
- Nhận xét về cách gọi tên muối
+ Muối được đặt tên theo quy tắc : Tên kim loại (hoá trị, đối với kim loại nhiều hoá trị) + tên gốc acid.
- Thành phần phân tử của muối gồm cation kim loại và anion gốc acid.
- Đa số các muối là chất rắn, có muối không tan hoặc tan ít trong nước. Các bảng tính tan được xây dựng để tiện sử dụng.
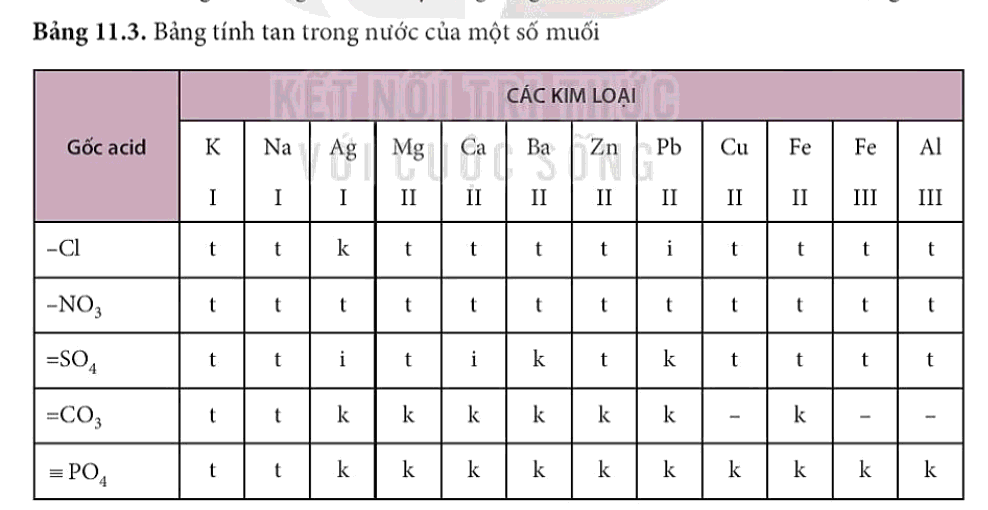
- Dung dịch muối có thể tác dụng với một số kim loại tạo thành muối mới và kim loại mới.
- Muối có thể tác dụng với một số dung dịch acid tạo thành muối mới và acid mới, sản phẩm của phản ứng có thể là chất ít tan hoặc không tan.
- Dung dịch muối tác dụng với dung dịch base
- Dung dịch muối tác dụng với dung dịch base tạo thành muối mới và base mới, trong đó có ít nhất một sản phẩm là chất khi/chất ít tan/không tan..
Vi du: FeSO4+2NaOH→→ Fe(OH)2+ Na2SO4
- Dung dịch muối tác dụng với dung dịch muối
- Hai dung dịch muối tác dụng với nhau tạo thành hai muối mới, trong đó ít nhất có một muối không tan hoặc ít tan.
- Muối có thể điều chế bằng một số phương pháp như sau:
+ Dung dịch acid tác dụng với base.
+ Dung dịch acid tác dụng với muối.
+ Oxide acid tác dụng với dung dịch base.