Với giải Câu hỏi 1 trang 94 Hóa học lớp 10 Chân trời sáng tạo chi tiết tron Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Câu hỏi 1 trang 94 Hóa học 10: Quan sát hình trong phần Khởi động, nhận xét về mức độ nhanh hay chậm của phản ứng hóa học xảy ra trong đám cháy lá cây khô và thân tàu biển bị oxi hóa trong điều kiện tự nhiên

Lời giải:
- Trong đám cháy của lá cây khô: Phản ứng hóa học xảy ra nhanh. Các lá cây nhanh chóng bị cháy và chuyển thành tro
- Thân tàu biển bị oxi hóa trong điều kiện tự nhiên: Phản ứng hóa học xảy ra chậm. Vỏ tàu biển làm bằng thép mất thời gian rất lâu mới bị gỉ (bị oxi hóa)
Lý thuyết Tốc độ phản ứng
1. Khái niệm tốc độ phản ứng hóa học
- Tốc độ phản ứng của phản ứng hóa học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Tốc độ phản ứng hóa học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng.
- Tốc độ phản ứng kí hiệu là v, có đơn vị: (đơn vị nồng độ)/ (đơn vị thời gian).
- Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
- Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó
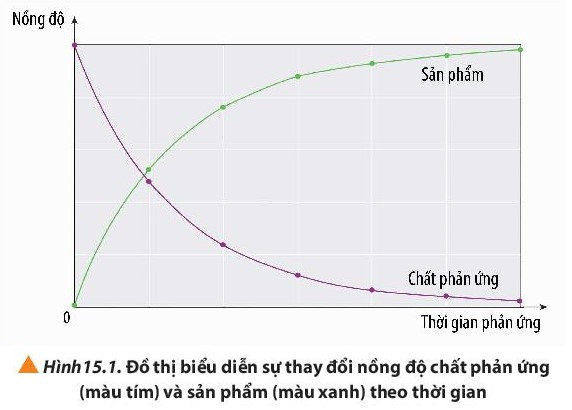
2. Tính tốc độ trung bình của phản ứng hóa học
Cho phản ứng tổng quát: aA + bB → cC + dD
Biểu thức tốc độ trung bình của phản ứng:
Trong đó:
: tốc độ trung bình của phản ứng
∆C = C2 – C1: sự biến thiên nồng độ
∆t = t2 – t1: biến thiên thời gian
C1, C2 là nồng độ của một chất tại hai thời điểm tương ứng t1 và t2.
Ví dụ: Trong phản ứng hóa học: N2O5(g) → N2O4(g) + O2(g)
Sau 184 giây đầu tiên, nồng độ của N2O4 là 0,25M. Tốc độ trung bình của phản ứng theo nồng độ N2O4 trong khoảng thời gian trên là:
= 1,36.10-3 (M/s)
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Luyện tập trang 95 Hóa học 10: Xét phản ứng phân hủy N2O5 ở 45oC...
Luyện tập trang 96 Hóa học 10: Cho phản ứng đơn giản sau:...
Bài 1 trang 97 Hóa học 10: Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O2(g) → 2NO2(g)...
Bài 3 trang 97 Hóa học 10: Cho phản ứng:...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Bài 18: Hydrogen halide và một số phản ứng của ion halide