Với tóm tắt lý thuyết Hóa học lớp 11 Bài 1: Khái niệm về cân bằng hóa học sách Kết nối tri thức hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa học lớp 11 Bài 1: Khái niệm về cân bằng hóa học
A. Lý thuyết Khái niệm về cân bằng hóa học
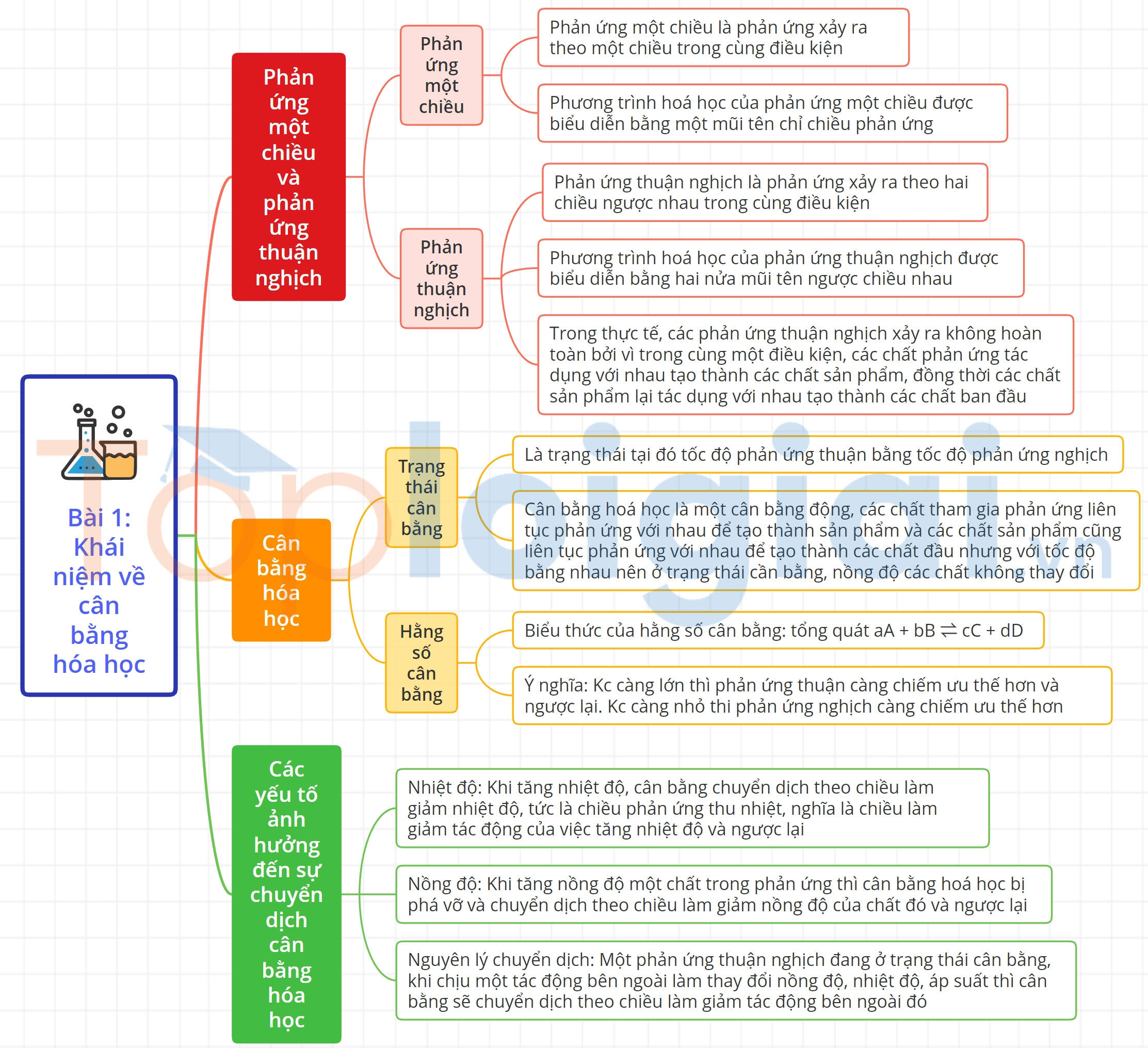
1. Phản ứng một chiều và phản ứng thuận nghịch
a. Phản ứng một chiều
- Phản ứng một chiều là phản ứng xảy ra theo một chiều trong cùng điều kiện. Phương trình hoá học của phản ứng một chiều được biểu diễn bằng một mũi tên chỉ chiều phản ứng.
Ví dụ: NaOH + HCl → NaCl + H2O
b. Phản ứng thuận nghịch
- Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
- Phương trình hoá học của phản ứng thuận nghịch được biểu diễn bằng hai nửa mũi tên ngược chiều nhau. Chiều từ trái sang phải là chiều phản ứng thuận, chiều từ phải sang trái là chiều phản ứng nghịch.
- Trong thực tế, các phản ứng thuận nghịch xảy ra không hoàn toàn bởi vì trong cùng một điều kiện, các chất phản ứng tác dụng với nhau tạo thành các chất sản phẩm (phản ứng thuận), đồng thời các chất sản phẩm lại tác dụng với nhau tạo thành các chất ban đầu (phản ứng nghịch).
Ví dụ: Cl2 + H2O ⇌ HCl + HClO
2. Cân bằng hóa học
a. Trạng thái cân bằng
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Cân bằng hoá học là một cân bằng động, các chất tham gia phản ứng liên tục phản ứng với nhau để tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau để tạo thành các chất đầu nhưng với tốc độ bằng nhau nên ở trạng thái cần bằng, nồng độ các chất không thay đổi.
b. Hằng số cân bằng
* Biểu thức của hằng số cân bằng
Xét phản ứng thuận nghịch tổng quát aA + bB ⇌ cC + dD:
Ở trạng thái cân bằng, hằng số cân bằng (Kc) của phản ứng được xác định theo biểu thức:
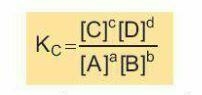
Trong đó: [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng. a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hoá học của phản ứng. Thực nghiệm cho thấy hằng số cân bằng Kc của một phản ứng thuận nghịch chỉ phụ thuộc nhiệt độ và bản chất của phản ứng. Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng.
* Ý nghĩa của hằng số cân bằng
Hằng số cân bằng Kc phụ thuộc vào bản chất của phản ứng và nhiệt độ. Từ biểu thức xác định hằng số cân bằng Kc, ta có thể thấy rằng: Kc càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại. Kc càng nhỏ thi phản ứng nghịch càng chiếm ưu thế hơn.
3. Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học
a. Ảnh hưởng của nhiệt độ
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phân ứng thu nhiệt ( Ar, Ho298> 0), nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại
b. Ảnh hưởng của nồng độ
Khi tăng nồng độ một chất trong phản ứng thì cân bằng hoá học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
c. Nguyên lý chuyển dịch cân bằng Le Chatelier
Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Nguyên lí chuyển dịch cân bằng Le Chatelier có ý nghĩa rất lớn khi được vận dụng vào kĩ thuật công nghiệp hoá học. Người ta có thể thay đổi các điều kiện để chuyển dịch cân bằng theo chiều mong muốn, làm tăng hiệu suất của phản ứng
Sơ đồ tư duy Khái niệm về cân bằng hóa học
B. 15 câu Trắc nghiệm Khái niệm về cân bằng hóa học
Câu 1: Các yếu tố có thể ảnh hưởng đến cân bằng hoá học là
A. nồng độ, nhiệt độ và chất xúc tác.
B. nồng độ, áp suất và diện tích bề mặt.
C. nồng độ, nhiệt độ và áp suất.
D. áp suất, nhiệt độ và chất xúc tác.
Đáp án đúng là: C
Theo nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài như biến đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Câu 2: Cho phản ứng hoá học sau:
Yếu tố nào sau đây cần tác động để cân bằng trên chuyển dịch sang phải?
A. Thêm chất xúc tác.
B. Giảm nồng độ N2 hoặc H2.
C. Tăng áp suất.
D. Tăng nhiệt độ.
Đáp án đúng là: C
Khi tăng áp suất chung của hệ thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số mol khí và ngược lại. Nên để cân bằng trên chuyển dịch sang phải thì cần tăng áp suất.
Câu 3: Hằng số cân bằng KC của một phản ứng thuận nghịch phụ thuộc vào yếu tố nào sau đây?
A. Nồng độ
B. Nhiệt độ
C. Áp suất
D. Chất xúc tác
Đáp án đúng là: B
KC chỉ phụ thuộc nhiệt độ và bản chất của phản ứng, không phụ thuộc nồng độ ban đầu của các chất.
Câu 4: Biểu thức tính hằng số cân bằng (KC) của phản ứng tổng quát: aA + bB cC + dD là
A.
B.
C.
D.
Đáp án đúng là: C
Biểu thức tính hằng số cân bằng (KC) của phản ứng tổng quát: aA + bB cC + dD là
Câu 5: Xét cân bằng sau:
Nếu tăng nồng độ SO2(g) (các điều kiện khác giữ không đổi), cân bằng sẽ chuyển dịch theo chiều cao?
A. Chuyển dịch theo chiều nghịch.
B. Chuyển dịch theo chiều thuận.
C. Có thể chuyển dịch theo chiều thuận hoặc nghịch tùy thuốc vào lượng SO2 thêm vào.
D. Không thay đổi.
Đáp án đúng là: B
Khi tăng nồng độ một chất trong phản ứng thì cân bằng hoá học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại. Vậy khi tăng nồng độ SO2(g) (các điều kiện khác giữ không đổi), cân bằng sẽ chuyển dịch theo chiều thuận.
Câu 6 Phản ứng thuận nghịch là phản ứng
A. chỉ xảy ra theo một chiều nhất định.
B. xảy ra giữa hai chất khí.
C. xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
D. có phương trình hoá học được biểu diễn bằng mũi tên một chiều.
Đáp án đúng là: C
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
Câu 7: Nhận xét nào sau đây không đúng?
A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện.
Đáp án đúng là: C
Phản ứng một chiều là phản ứng xảy ra hoàn toàn.
Câu 8: Yếu tố nào sau đây luôn luôn không làm dịch chuyển cân bằng của hệ phản ứng?
A. Nhiệt độ.
B. Áp suất.
C. Nồng độ.
D. Chất xúc tác.
Đáp án đúng là: D
Các yếu tố có thể ảnh hưởng đến cân bằng hoá học là nồng độ, nhiệt độ và áp suất.
Câu 9: Phản ứng nào sau đây là phản ứng thuận nghịch?
A. Mg + 2HCl → MgCl2 + H2.
B. 2SO2 + O2 2SO3.
C. C2H5OH + 3O2 2CO2 + 3H2O.
D. 2KClO3 2KCl + 3O2
Đáp án đúng là: B
Biểu diễn PTHH của phản ứng thuận nghịch dùng hai nửa mũi tên 1 chiều nhau
Ví dụ: 2SO2 + O2 2SO3.
Câu 10: Trong các phát biểu sau đây, phát biểu nào đúng khi một hệ ở trạng thái cân bằng?
A. Phản ứng thuận đã dừng.
B. Phản ứng nghịch đã dừng.
C. Nồng độ chất tham gia và sản phẩm bằng nhau.
D. Nồng độ của các chất trong hệ không đổi.
Đáp án đúng là: D
Khi một hệ ở trạng thái cân bằng, nồng độ của các chất trong hệ không đổi.
Câu 11: Cho phản ứng hoá học sau: H2(g) + Br2(g) 2HBr(g)
Biểu thức hằng số cân bằng (KC) của phản ứng trên là
A.
B.
C.
D.
Đáp án đúng là: B
Biểu thức hằng số cân bằng (KC) của phản ứng:H2(g) + Br2(g) 2HBr(g) là
Câu 12: Biểu thức nào sau đây là biểu thức hằng số cân bằng (KC) của phản ứng:
C(S) + 2H2 (g) CH4(g)?
A.
B.
C.
D.
Đáp án đúng là: D
Biểu thức hằng số cân bằng (KC) của phản ứng C(S) + 2H2 (g)CH4(g) là:
Câu 13: Viết biểu thức tính hằng số cân bằng của phản ứng sau:
CH3COOH(l) + C2H5OH(l) CH3COOC2H5(l) + H2O(l)
A.
B.
C.
D.
Đáp án đúng là: A
Biểu thức tính hằng số cân bằng của phản ứng:CH3COOH(l) + C2H5OH(l) CH3COOC2H5(l) + H2O(l) là
Câu 14: Biểu thức tính hằng số cân bằng của phản ứng: CaO(s) + CO2(g) CaCO3(s) là
A.
B.
C.
D.
Đáp án đúng là: D
Biểu thức tính hằng số cân bằng của phản ứng: CaO(s) + CO2(g) CaCO3(s) là
Câu 15: Xét cân bằng:
(1) H2(g) + I2(g) 2HI(g) KC(1)
(2) H2(g) + I2(g)HI(g) KC(2)
Mối quan hệ giữa KC(1) và KC(2) là
A. KC(1) = KC(2).
B. KC(1) = (KC(2))2.
C.
D.
Đáp án đúng là: B
Video bài giảng Hóa học 11 Bài 1: Khái niệm về cân bằng hoá học - Kết nối tri thức
Xem thêm các bài tóm tắt Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 1: Khái niệm về cân bằng hoá học
Lý thuyết Bài 2: Cân bằng trong dung dịch nước
Lý thuyết Bài 5: Ammonia. Muối ammonium
Lý thuyết Bài 6: Một số hợp chất của nitrogen với oxygen