Với tóm tắt lý thuyết Hóa học lớp 9 Sắt hay, chi tiết cùng với 22 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 9.
Hóa học 9 Bài 19: Sắt
A. Lý thuyết Sắt
Sắt là kim loại màu trắng xám, khi ở dạng bột có màu đen.
Sắt có tính nhiễm từ (bị nam châm hút và sắt cũng có thể nhiễm từ trở thành nam châm). Khối lượng riêng D = 7,86g/cm3, nóng chảy ở 1539°C.
Sắt dẻo nên dễ rèn.
Sắt có những tính chất hóa học của kim loại
1. Tác dụng với nhiều phi kim
Sắt tác dụng với oxi tạo thành oxit, tác dụng với nhiều phi kim tạo thành muối.
Ví dụ:
2. Tác dụng với dung dịch axit
Sắt tác dụng với dung dịch axit HCl và H2SO4 loãng tạo thành muối sắt (II) và giải phóng H2.
Phương trình hóa học:
Fe + 2HCl → FeCl2 + H2
Fe + H2SO4 → FeSO4 + H2
Chú ý: Sắt không tác dụng với HNO3 đặc, nguội và H2SO4 đặc, nguội.
Khi sắt phản ứng với HNO3 loãng, H2SO4 đặc, nóng sản phẩm thu được chứa muối sắt (III) và không giải phóng H2.
3. Tác dụng với dung dịch muối của kim loại yếu hơn
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu
B. Trắc nghiệm Sắt
Bài 1: Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch?
A. FeCl3.
B. CuSO4.
C. AgNO3.
D. MgCl2.
Lời giải
Kim loại Fe không phản ứng được với dung dịch MgCl2 vì Mg mạnh hơn Fe trong dãy hoạt động hóa học
Đáp án: D
Bài 2: Một tấm kim loại bằng vàng bị bám một lớp kim loại sắt ở bề mặt, để làm sạch tấm kim loại vàng ta dùng:
A. Dung dịch CuSO4 dư
B. Dung dịch FeSO4 dư
C. Dung dịch ZnSO4 dư
D. Dung dịch H2SO4 loãng dư
Lời giải
Fe có thể đẩy Cu khỏi muối CuSO4 nhưng lại tạo thành kim loại Cu bám lên tấm kim loại vàng => loại A
CuSO4 + Fe → Cu + FeSO4
Fe đứng trước H2 trong dãy điện hóa do đó sẽ tan trong H2SO4 loãng tạo thành dd và không có thêm kim loại bám vào vàng
Fe + H2SO4 → FeSO4 + H2
Đáp án: D
Bài 3: Ở nhiệt độ cao sắt phản ứng với lưu huỳnh cho:
A. FeS2
B. FeS
C. Fe2S2
D. FeS hoặc FeS2
Lời giải
Khi cho sắt phản ứng với lưu huỳnh ở nhiệt độ cao tạo muối sắt (II) có màu đen
Fe + S 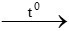 FeS
FeS
Đáp án: B
Bài 4: Kim loại Fe tác dụng được với bao nhiêu chất trong dãy sau: HCl, H2SO4 đặc nguội, dd NaOH, dd Al(NO3)3; khí Cl2
A. 2 B. 3
C. 4 D. 5
Lời giải
Kim loại Fe tác dụng được với: HCl, khí Cl2
Đáp án: A
Bài 5: Thí nghiệm không xảy ra phản ứng là
A. cho sắt vào dung dịch HCl.
B. cho sắt vào dung dịch H2SO4 loãng.
C. cho sắt vào dung dịch HNO3 loãng.
D. cho sắt vào dung dịch H2SO4 đặc nguội.
Lời giải
Thí nghiệm không xảy ra phản ứng là: cho sắt vào dung dịch H2SO4 đặc nguội.
Đáp án: D
Bài 6: Ngâm một cây đinh sắt sạch vào dung dịch bạc nitrat. Hiện tượng xảy ra là
A. sắt bị hòa tan một phần, bạc được giải phóng.
B. bạc được giải phóng nhưng sắt không biến đổi.
C. không có chất nào sinh ra, chỉ có sắt bị hòa tan.
D. không xảy ra hiện tượng gì.
Lời giải
Ngâm một cây đinh sắt sạch vào dung dịch bạc nitrat xảy ra phản ứng:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
=> Hiện tượng xảy ra là: sắt bị hòa tan một phần, bạc được giải phóng.
Đáp án: A
Bài 7: Tính chất vật lí nào sau đây của sắt khác với các kim loại khác?
A. Dẫn nhiệt
B. Tính nhiễm từ
C. Dẫn điện
D. Ánh kim
Lời giải
Tính chất vật lí của sắt khác với các kim loại khác là: tính nhiễm từ
Đáp án: B
Bài 8: Phương trình hóa học nào sau đây không đúng?
A. Fe + S 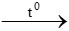 FeS
FeS
B. 4Fe + 3O2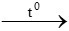 2Fe2O3
2Fe2O3
C. 2Fe + 3Cl2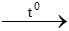 2FeCl3
2FeCl3
D. Fe + 2HCl → FeCl2 + H2
Lời giải
Phương trình không đúng là: 4Fe + 3O2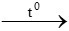 2Fe2O3
2Fe2O3
Sắt tác dụng với oxi tạo oxit sắt từ: 3Fe + 2O2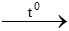 Fe3O4
Fe3O4
Đáp án: B
Bài 9: Sắt vừa thể hiện hóa trị II, vừa thể hiện hóa trị III khi tác dụng với
A. Cl2.
B. dung dịch HCl.
C. O2.
D. S.
Lời giải
Sắt vừa thể hiện hóa trị II, vừa thể hiện hóa trị III khi tác dụng với O2
PTHH: 3Fe + 2O2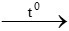 Fe3O4
Fe3O4
Đáp án: C
Bài 10: Đốt cháy 1 mol sắt trong oxi, thu được 1 mol sắt oxit. Công thức oxit sắt này là:
A. FeO
B. Fe2O3
C. Fe3O4
D. Fe3O2
Lời giải
1mol Fe → 1 mol oxit sắt → CT có chứa 1 nguyên tử Fe
→ CT : FeO
Đáp án: A
Câu 11: Cho dây sắt quấn hình lò xo (đã được nung nóng đỏ) vào lọ đựng khí clo. Hiện tượng xảy ra là:
A. Sắt cháy tạo thành khói trắng dày đặt bám vào thành bình
B. Không thấy hiện tượng phản ứng
C. Sắt cháy sáng tạo thành khói màu nâu đỏ
D. Sắt cháy sáng tạo thành khói màu đen
Sắt cháy trong clo tạo thành muối FeCl3 có màu nâu đỏ
2Fe + 3Cl2 → 2FeCl3 (nâu đỏ)
Đáp án: C
Câu 12: Thí nghiệm tạo ra muối sắt (III) sunfat là
A. sắt phản ứng với dung dịch H2SO4 đặc nóng.
B. sắt phản ứng với dung dịch H2SO4 loãng
C. sắt phản ứng với dung dịch CuSO4.
D. sắt phản ứng với dung dịch Al2(SO4)3
Đáp án: A
Câu 13: Để chuyển FeCl3 thành Fe(OH)3, người ta dùng dung dịch:
A. HCl
B. H2SO4
C. NaOH
D. AgNO3
Từ muối tạo thành bazo ta cần cho muối tác dụng với bazo tan để tạo thành muối mới và bazo mới hoặc cho tác dụng với muối mà sản phẩm muối mới kém bền chuyển thành hidroxit
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Đáp án: C
Câu 14: Nung nóng Fe(OH)3 đến khối lượng không thay đổi, chất rắn thu được sau phản ứng là:
A. Fe3O4
B. Fe2O3
C. FeO
D. Fe
Đáp án: B
Câu 15: Kim loại nào sau đây đẩy được Fe ra khỏi dung dịch muối FeCl2 ?
A. Mg
B. Cu
C. Ag
D. Ni
Kim loại đẩy được Fe ra khỏi dung dịch muối FeCl2 là Mg:
Mg + FeCl2 → Fe + MgCl2
Đáp án: A
Câu 16: Nhúng 1 lá Fe nhỏ vào dung dịch dư chứa một trong những chất sau: FeCl3, AlCl3, NaCl, AgNO3, HNO3 loãng, H2SO4 đặc, nóng. Số trường hợp phản ứng tạo muối Fe(II) là:
A. 1
B. 2
C. 3
D. 4
Số trường hợp phản ứng tạo muối Fe(II) là : FeCl3
Đáp án: A
Câu 17: Hòa tan hỗn hợp gồm Fe và Cu vào dung dịch HCl vừa đủ. Các chất thu được sau phản ứng là
A. FeCl2 và H2.
B. FeCl2, Cu và H2.
C. Cu và khí H2.
D. FeCl2 và Cu.
Vì Cu không phản ứng với dung dịch HCl => sau phản ứng còn Cu
Fe phản ứng với HCl: Fe + 2HCl → FeCl2 + H2
Vậy các chất thu được là: FeCl2, Cu và H2
Đáp án: B
Câu 18: Hoà tan hỗn hợp gồm Fe và Cu vào dung dịch HCl (vừa đủ). Các sản phẩm thu được sau phản ứng là
A. FeCl2 và khí H2
B. FeCl2, Cu và khí H2
C. Cu và khí H2
D. FeCl2 và Cu
Khi cho Fe và Cu vào dd HCl thì chỉ có Fe phản ứng với HCl do Fe đứng trước H2 do đó có phản ứng tan ra tạo khí còn Cu đứng sau H2 trong dãy điện hóa nên không có phản ứng
Fe + 2HCl → FeCl2 + H2
Đáp án: B
Câu 19: Hòa tan 8,4 gam Fe bằng dung dịch HCl dư, thu được V lít khí H2 (đktc). Giá trị của V là
A. 2,24
B. 4,48
C. 3,36
D. 1,12
Đáp án: C
Câu 20: Để khử hoàn toàn 8 gam Fe2O3 bằng bột nhôm ở nhiệt độ cao, trong điều kiện không có không khí thì khối lượng bột nhôm cần dùng là
A. 2,7 gam.
B. 4,05 gam.
C. 5,40 gam.
D. 6,75 gam.
Đáp án: A
Câu 21: Hòa tan hết 2,8 gam kim loại Fe vào cốc đựng 60 gam dung dịch HCl 7,3% thu được khí H2 và dung dịch X. Nồng độ phần trăm của muối sắt (II) clorua trong dung dịch sau phản ứng là
A. 9,11%.
B. 10,03%.
C. 10,13%.
D. 12,13%.
Đáp án: C
Câu 22: Có thể phân biệt Fe và Al bằng dung dịch:
A. NaOH.
B. HCl.
C. H2SO4 (loãng).
D. CuSO4.
Al tác dụng được với dd NaOH còn Fe thì không => dùng dd NaOH để phân biệt
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Đáp án: A