Tailieumoi.vn giới thiệu Giải bài tập Hóa học 9 Bài 19: Sắt chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Sắt lớp 9.
Giải bài tập Hóa học lớp 9 Bài 19: Sắt
Câu hỏi và bài tập (trang 60 sgk Hóa học lớp 9)
1. Tác dụng với phi kim
a) Tác dụng với oxi.
3Fe + 2O2 Fe3O4 (oxit sắt từ, sắt có hóa trị II và III)
b) Tác dụng với phi kim khác.
2Fe + 3Cl2 2FeCl3
Lưu ý: Fe tác dụng với clo chỉ cho Fe(III) clorua (không cho Fe(II) clorua)
2. Tác dụng với dung dịch axit:
Sắt tác dụng với HCl, H2SO4 loãng tạo thành muối sắt (II) và giải phóng H2.
Fe + 2HCl → FeCl2, + H2 ↑
Chú ý:
+ Fe tác dụng với dung dịch HCl chỉ cho Fe(II) clorua (không cho Fe(III) clorua)
+ Sắt không tác dụng với HNO3, H2S04đặc, nguội.
3. Tác dụng với dung dịch muối của kim loại yếu hơn sắt.
Fe + CuSO4 → FeSO4 + Cu↓
Fe3O4 , Fe2O3 và ghi rõ điều kiện phản ứng, nếu có.
Lời giải:
Phương trình hóa học điều chế Fe304 từ Fe và O2
a) 3Fe + 2O2 Fe304
Phương trình hóa học điều chế Fe203 từ Fe, Cl2 và NaOH
2Fe + 3Cl2 2FeCl3
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓
2Fe(OH)3 Fe2O3 + 3H2O
Cách 1: Có thể dùng nam châm hút sắt => tách riêng lấy Fe
Cách 2: có thể dùng dung dịch NaOH tác dụng với hỗn hợp Al, Fe. Khi đó chỉ có Al phản ứng, Fe không phản ứng, còn lại chất rắn sau phản ứng => lọc bỏ dung dịch ta thu được Fe tinh khiết.
+ Cách 1: Có thể dùng nam châm hút sắt => tách riêng lấy Fe
+ Cách 2: Bột sắt kim loại có lẫn tạp chất là nhôm. Phương pháp làm sạch sắt là hòa tan trong dung dịch NaOH dư, Al sẽ tan và còn lại là Fe nguyên chất
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Lọc bỏ dung dịch, chất rắn thu được là Fe.
a) Dung dịch muối Cu(NO3)2 ;
b) H2SO4 đặc, nguội;
c) Khí Cl2 ;
d) Dung dịch ZnSO4.
Viết các phương trình hoá học và ghi điều kiện, nếu có.
Sắt không tác dụng với: H2SO4 đặc, nguội và dung dịch ZnSO4.
Sắt tác dụng với dung dịch Cu(N03)2 và khí Cl2.
Phương trình hóa học:
a) Cho A tác dụng với dung dịch HCl dư. Tính khối lượng chất rắn còn lại sau phản ứng.
b) Tính thể tích dung dịch NaOH 1M vừa đủ để kết tủa hoàn toàn dung dịch B.
Tính số mol CuS04 = ?
Viết PTHH: Fe + CuS04 → FeS04 + Cu↓ (1)
Chất rắn A gồm Cu và Fe dư. Cho tác dụng với HCl dư thì chỉ còn lại chất rắn là Cu
Dựa vào PTHH (1) tính được mol Cu từ mol CuS04 => mrắn = mCu = ?
b) PTHH: FeSO4 + 2NaOH → Na2SO4 + Fe(OH)2
Tính được số mol FeSO4 từ PTHH (1)
Dựa vào PTHH ( 2) tính được số mol của NaOH theo số mol của FeSO4
Số mol đồng sunfat = 1.0,01 = 0,01 mol
Phương trình hóa học giữa sắt dư với đồng sunfat:
Fe + CuS04 → FeS04 + Cu (1)
Phản ứng: 0,01 0,01 → 0,01 0,01 (mol)
a) Chắt rắn A gồm: Cu và Fe dư
Phương trình hóa học của phản ứng giữa A với dd HCl dư:
Fe + 2HCl → FeCl2 + H2 (2)
Chất rắn còn lại sau phản ứng (2) là Cu
Lượng chất rắn còn lại sau phản ứng (2) là 0,01.64 = 0,64 gam
b) Dung dịch B chứa FeSO4
Phương trình hóa học của phản ứng giữa dd B với dd NaOH 1M:
FeSO4 + 2NaOH → Na2SO4 + Fe(OH)2 (3)
Theo phương trình : số mol NaOH phản ứng = 0,02 mol
Thể tích dung dịch NaOH 1M = = = 0,02 lit=20ml
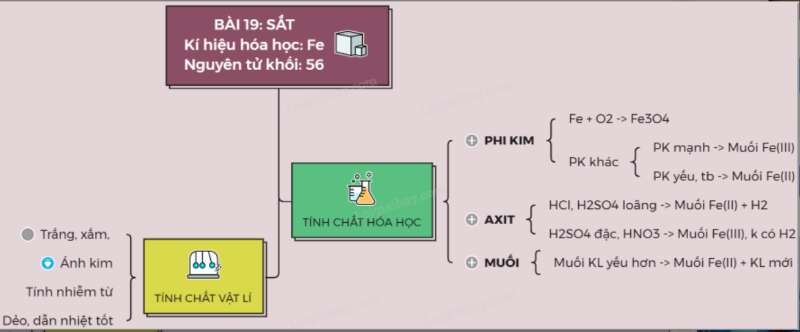
I. TÍNH CHẤT VẬT LÍ:
- Sắt là kim loại, màu trắng xám, có tính dẻo, ánh kim, dẫn điện, dẫn nhiệt tốt nhưng kém nhôm
- Sắt có tính nhiễm từ (bị nam châm hút)
- Sắt là kim loại nặng, khối lượng riêng 7,86g/cm3, nóng chảy ở nhiệt độ 15390C
II. TÍNH CHẤT HÓA HỌC:
Sắt là kim loại có hai hóa trị là II và III.
1. Tác dụng với phi kim
a) Tác dụng với oxi.
3Fe + 2O2 Fe3O4 (oxit sắt từ, là oxit hỗn hợp: FeO.Fe2O3)
b) Tác dụng với phi kim khác.
- Tác dụng với Cl2 tạo muối sắt (III): 2Fe + 3Cl2 2FeCl3
- Tác dụng với S tạo muối sắt (II): Fe + S FeS
Ngoài oxi và lưu huỳnh, sắt có thể tác dụng được với nhiều phi kim khác như Cl2, Br2,… tạo thành muối
2. Tác dụng với dung dịch axit
- Sắt tác dụng với HCl, H2SO4 loãng tạo thành muối sắt (II) và giải phóng H2.
Fe + 2HCl → FeCl2 + H2
Fe bị thụ động hóa trong axit HNO3 đặc nguội và axit H2SO4 đặc nguội do tạo ra lớp oxit bảo vệ, ngăn cản kim loại tác dụng với axit
- Sắt tác dụng với HNO3 đặc nóng, H2SO4 đặc nóng tạo thành muối sắt III, không giải phóng H2
Fe + H2SO4 đặc Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3 đặc Fe(NO3)3 + 3NO2 + H2O
3. Tác dụng với dung dịch muối
- Sắt tác dụng với dung dịch muối của những kim loại kém hoạt động hơn, tạo thành dung dịch muối sắt và giải phóng kim loại trong muối
Fe + CuSO4 → FeSO4 + Cu
Sơ đồ tư duy: Sắt
Dạng 1: Lý thuyết về kim loại sắt
Ví dụ 1: Để chuyển FeCl3 thành Fe(OH)3, người ta dùng dung dịch:
A. HCl
B. H2SO4
C. NaOH
D. AgNO3
Hướng dẫn giải chi tiết:
Từ muối tạo thành bazo ta cần cho muối tác dụng với bazo tan để tạo thành muối mới và bazo mới hoặc cho tác dụng với muối mà sản phẩm muối mới kém bền chuyển thành hidroxit
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Đáp án C
Ví dụ 2: Thí nghiệm tạo ra muối sắt (III) sunfat là
A. Sắt phản ứng với dung dịch H2SO4 đặc nóng.
B. Sắt phản ứng với dung dịch H2SO4 loãng.
C. Sắt phản ứng với dung dịch CuSO4.
D. Sắt phản ứng với dung dịch Al2(SO4)3.
Hướng dẫn giải chi tiết:
A. Fe + H2SO4 đặc Fe2(SO4)3 + 3SO2 + 6H2O
B. Fe + H2SO4→ FeSO4+ H2
C. Fe + CuSO4 → FeSO4 + Cu
D. Fe không phản ứng với dung dịch Al2(SO4)3.
Đáp án A
Ví dụ 3: Ngâm một cây đinh sắt sạch vào dung dịch bạc nitrat. Hiện tượng xảy ra là
A. sắt bị hòa tan một phần, bạc được giải phóng.
B. bạc được giải phóng nhưng sắt không biến đổi.
C. không có chất nào sinh ra, chỉ có sắt bị hòa tan.
D. không xảy ra hiện tượng gì.
Hướng dẫn giải chi tiết:
Ngâm một cây đinh sắt sạch vào dung dịch bạc nitrat xảy ra phản ứng:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
=> Hiện tượng xảy ra là: sắt bị hòa tan một phần, bạc được giải phóng.
Đáp án A
Ví dụ 4: Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch?
A. FeCl3
B. CuSO4
C. AgNO3
D. MgCl2
Dạng 2: Một số bài tập tính toán điển hình
Ví dụ 1: Hoà tan 16,8g kim loại hoá trị II vào dung dịch HCl dư, sau phản ứng thu được 6,72 lít khí H2 (đktc). Kim loại đem hoà tan là:
Hướng dẫn giải chi tiết:
Gọi A là kim loại cần tìm
A + 2HCl → ACl2 + H2
nH2 = VH2 : 22,4 = 6,72 : 22,4 = 0,3 mol
từ pthh ta có nA = nH2 = 0,3 mol
=> MA = mA : nA = 16,8 : 0,3 = 56g/mol => A là sắt
Ví dụ 2: Nhúng một thanh sắt vào dung dịch CuSO4, sau một thời gian thấy khối lượng chất rắn tăng 1,6 gam. Số mol CuSO4 đã tham gia phản ứng là:
Hướng dẫn giải chi tiết:
Gọi số mol của CuSO4 phản ứng là x (mol)
PTPƯ: Fe + CuSO4 → FeSO4 + Cu↓
x ← x → x (mol)
Khối lượng tăng: mtăng = mCu - mFe
=> 1,6 = 64x – 56x
=> 1,6 = 8x
=> x = 0,2 (mol)
Ví dụ 3: Cần 10,752 lít CO để khử hoàn toàn 27,84 gam oxit sắt thu được sắt và khí cacbonic. Công thức của oxit sắt là
Hướng dẫn giải chi tiết:
nCO = 0,48 mol
yCO + FexOy → xFe + yCO2.
0,48 → 0,48/y
Ví dụ 4: Nung hỗn hợp chứa FeCO3 và FexOy cần dùng 1,12 lít O2 (đktc) thu được 16 gam Fe2O3 và khí CO2. Hấp thụ toàn bộ lượng khí CO2 bằng dung dịch Ca(OH)2 thấy khối lượng bình tăng 6,6 gam. Công thức của oxit sắt là
Hướng dẫn giải chi tiết:
nFe2O3 = 0,1, nO2 = 0,05 mol
Khối lượng bình tăng là khối lượng CO2 ⟹ mCO2 = 6,6 gam, nCO2 = 0,15 mol
FeCO3 → FeO + CO2.
0,15 0,15 ← 0,15
2FeO + 0,5O2 → Fe2O3. (1)
0,15 →0,0375 0,075
2FexOy + (3x – 2y)/2 O2 → xFe2O3. (2)
0,025.(3x – 2y)/2x ← 0,1 – 0,075 = 0,025
Từ (2) nO2 = 0,05 – 0,0375
= ⟹ ⟹ FeO