Tài liệu Bộ đề thi Hóa học lớp 9 học kì 2 năm học 2023 - 2024 gồm 20 đề thi tổng hợp từ đề thi môn Hóa học 9 của các trường THCS trên cả nước đã được biên soạn đáp án chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi học kì 2 Hóa học lớp 9. Mời các bạn cùng đón xem:
Chỉ từ 180k mua trọn bộ Đề thi học kì 2 Hóa học 9 bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 1)
Phần tự luận
Câu 1: (2 điểm) Viết các phương trình hóa học (điều kiện thích hợp) của cacbon lần lượt tác dụng với các chất sau: CuO, Fe2O3, O2.
Câu 2: (2 điểm) Cho các dung dịch sau: axit sunfuric loãng, axit axetic, rượu etylic.
Bằng phương pháp hóa học nhận biết từng chất.
Câu 3: (2 điểm) Một chất béo có công thức: C15H31COO-CH(CH2-OOC17H35)2 bị thủy phân trong dung dịch NaOH. Hãy viết phương trình hóa học.
Câu 4: (2,5 điểm) Sục khí CO2 vào dung dịch NaOH dư. Viết phương trình hóa học.
Sau phản ứng trong dung dịch sẽ tồn tại những chất gì?
Câu 5: (2,5 điểm) Tính nồng độ % của dung dịch rượu etylic 70° (biết DC2H5OH = 0,8 g/ml, DH2O = 1 g/ml, H=1, C=12, O=16).

Đáp án và hướng dẫn giải
Câu 1:
2CuO + C to→ 2Cu + CO2
2Fe2O3 + 3C to→ 4Fe + 3CO2
O2 + C to→ CO2
Câu 2: Có thể dùng BaCO3:
- Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho vào mỗi ống nghiệm một ít BaCO3.
- Ống nghiệm nào BaCO3 tan dần, có khí thoát ra là ống nghiệm chứa axit axetic.
- Ống nghiệm nào vừa có khí thoát ra vừa có kết tủa trắng là ống nghiệm chứa H2SO4.
BaCO3 + H2SO4 → BaSO4↓ + CO2↑ + H2O
BaCO3 + 2CH3COOH → (CH3COO)2Ba + CO2↑ + H2O
- Ống nghiệm nào không thấy hiện tượng gì là ống nghiệm chứa rượu etylic.
Câu 3:
C15H31COO–CH(CH2–OOCC17H35)2 + 3NaOH to→ C3H5(OH)3 + C15H31COONa + 2C17H35COONa
Câu 4:
CO2 + 2NaOH → Na2CO3+ H2O.
Trong dung dịch sau phản ứng có: Na2CO3, NaOH (dư).
Câu 5:
Trong 100ml dung dịch rượu etylic 70⁰ có 70ml rượu etylic và 30ml nước.
Khối lượng rượu etylic = 70 x 0,8 = 56 gam, khối lượng nước = 30 gam.
Khối lượng dung dịch = 56 + 30 = 86 gam.
Nồng độ % dung dịch rượu etylic
....................................
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 2)
Phần tự luận
Câu 1: (1,5 điểm) Viết 3 phương trình phản ứng điều chế glucozo.
Câu 2: (1,5 điểm) Để xác minh đường gluocozo (thường có trong nước tiểu của người bệnh đái đường) người ta chọn thuốc thử nào? Viết phương trình hóa học để minh họa.
Câu 3: (2 điểm) Khi đốt cháy cùng số mol các khí: CH4, C2H4, C3H4, C4H4. Tính tỉ lệ theo thể tích của khí oxi cần dùng để đốt cháy mỗi chất (đo cùng điều kiện).
Câu 4: (2,5 điểm) Xà phòng hóa hoàn toàn 964,2g một loại chất béo thuộc dạng (RCOO)3C3H5, cần vừa đủa 130g NaOH. Tính khối lượng muối của axit hữu cơ thu được (cho H=1, C=12, O=16, Na=23).
Câu 5: (2,5 điểm) Nhúng một thanh sắt vào dung dịch CuSO4 sau một thời gian lấy thanh sắt ra khổi dung dịch cân lại thấy nặng thêm 0,8g. Khối lượng dung dịch giảm so với ban đầu là bao nhiêu gam (Cu=64, Fe=56)?
Đáp án và hướng dẫn giải
Câu 1:
Từ saccarozo: C12H22O11 + H2O H2SO4→ 2C6H12O6
Từ tinh bột: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Từ xenlulozo: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Câu 2:
Dung dịch AgNO3 trong NH3
Ag2O + C6H12O6 NH3→ C6H12O7 + 2Ag
Câu 3:
CH4 + 2O2 to→ CO2 + 2H2O
C2H4 + 3O2 to→ 2CO2 + 2H2O
C3H4 + 4O2 to→ 3CO2 + 2H2O
C4H4 + 5O2 to→ 4CO2 + 2H2O
Tỉ lệ thể tích oxi cần dùng lần lượt: 2:3:4:5.
Câu 4:
(RCOO)3C3H5 + 3NaOH to→ C3H5(OH)3 + 3RCOONa
Dùng định luật bảo toàn khối lượng:
Khối lượng chất béo + khối lượng NaOH = Khối lượng C3H5(OH)3 + khối lượng muối của axit hữu cơ.
=> Khối lượng muối = 964,2 + 130 – 99,67 = 994,5 gam.
Câu 5:
Fe + CuSO4 → Cu + FeSO4
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi dung dịch. Thanh Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng bằng khối lượng thanh Fe tăng lên.
Vậy khối lượng thanh sắt tăng 0,8 gam → khối lượng dung dịch giảm so với ban đầu 0,8 gam.
.............................................
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 3)
Phần tự luận
Câu 1: (2 điểm) Viết các phương trình hóa học của khí SO2 với dung dịch KOH.
Câu 2: (2 điểm) Tính thể tích dung dịch CH3COOH 1,25M cần để trung hòa 60ml dung dịch NaOH 0,75M.
Câu 3: (2 điểm) Cho một dây nhôm vào dung dịch Cu(NO3)2. Sau một thời gian lấy dây nhôm ra khỏi dung dịch. Nhận xét hiện tượng.
Câu 4: (2 điểm) Cho 0,1 lít dung dịch glucozo 0,1M tác dụng vừa đủ với dung dịch AgNO3 trong NH3. Tính khối lượng Ag thu được (cho Ag = 108).
Câu 5: (2 điểm) Khi đốt cùng số mol các chất: rượu etylic, axit axetic và glucozo cần các thể tích khí oxi (đktc) lần lượt là V1, V2, V3.
Xác định thứ tự tăng dần của V1, V2, V3.

Đáp án và hướng dẫn giải
Câu 1:
SO2 + KOH → KHSO3
SO2 + 2KOH → K2SO3+ H2O
Câu 2:
CH3 – COOH + NaOH → CH3–COONa + H2O
nNaOH = 0,06 x 0,75 = 0,045 mol = nCH3COOH
Thể tích dung dịch CH3–COOH cần dùng = 0,045/1,25 = 0,036 (lít) hay 36ml.
Câu 3:
2Al + 3CuSO4 (dd màu xanh) → 3Cu + Al2(SO4)3
- Dây nhôm nhuốm màu đỏ.
- Màu xanh của dung dịch phai dần.
Câu 4:
C6H12O6 + Ag2O NH3→ C6H12O7 + 2 Ag
nAg = 2 x 0,1 x 0,1 = 0,02 mol => mAg = 0,02 x 108 = 2,16 gam
Câu 5:
C2H5OH + 3O2 to→ 2CO2 + 3H2O
CH3 – COOH + 2O2 to→ 2CO2 + 2H2O
C6H12O6 + 6O2 to→ 6CO2 + 6H2O
Từ các phản ứng suy ra: V2 < V1 < V3.
....................................
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 4)
Phần tự luận
Câu 1: (2 điểm) Nhỏ 10ml dung dịch AgNO3 1M trong NH3 vào ống nghiệm đựng dung dịch glucozo dư, sau khi kết thúc phản ứng, người ta thu được một lượng Ag cân nặng 0,864g. Tính hiệu suất phản ứng (Ag=108)
Câu 2: (2 điểm) Viết phương trình hóa học của H2N – CH2 – COOH lần lượt với NaOH, C2H5OH.
Câu 3: (2 điểm) Hai phân tử X và Y có công thức cấu tạo lần lượt là:
HO – CH2 – COOH và H2N – CH2 – COOH. Viết các phương trình hóa học với Na
Câu 4: (2 điểm) Hãy điền Đ (nếu đúng) S (nếu sai) vào bảng sau:
| STT | Đ hay S | |
| 1 | Glucozo tác dụng được với AgNO3 trong NH3 | |
| 2 | Saccarozo tác dụng được với H2O trong axit | |
| 3 | Xenlulozo không tác dụng với natri | |
| 4 | Tinh bột tác dụng với iot cho màu xanh | |
| 5 | Axit axetic tác dụng được với rượu etylic trong axit | |
| 6 | Amino axit bị thủy phân trong môi trường axit hay kiềm | |
| 7 | Rượu etylic tác dụng với natri | |
| 8 | Benzen không tác dụng với nước |
Câu 5: (2 điểm) Trộn 50ml axit axetic (D = 1,03 g/cm3) với 50ml nước cất (D = 1 g/cm3). Tính nồng độ % của axit axetic trong dung dịch đó.
Đáp án và hướng dẫn giải
Câu 1:
nAgNO3 ban đầu = 0,01 mol.
nAg tạo ra = 0,864/108 = 0,008 mol
Hiệu suất phản ứng =
Câu 2:
Viết phương trình hóa học:
H2N – CH2 – COOH + NaOH → H2N – CH2 – COONa + H2O
H2N – CH2 – COOH + C2H5OH ⇋ H2N – CH2 – COOC2H5 + H2O
Câu 3:
HO – CH2 – COOH + 2Na → NaO – CH2 – COONa + H2
2H2N – CH2 – COOH + 2Na → 2H2N – CH2 – COONa + H2
Câu 4: Chỉ có 6 sai (S).
Câu 5:
Khối lượng axit axetic = 50 x 1,03 = 51,5 gam
Khối lượng nước = 50 gam
Khối lượng dung dịch axit sau khi trộn = 50 + 51,5 = 101,5 gam.
Nồng độ % của axit axetic là:
..................................................
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 5)
Phần trắc nghiệm (Mỗi câu 0,5 điểm)
Câu 1: Dãy các chất làm mất màu dung dịch nước brom là
A. C2H2, C6H6, CH4
B. C2H2, CH4, C2H4
C. C2H2, C2H4
D. C2H2, H2, CH4
Câu 2: Dẫn 0,56 lít khí etilen (đktc) vào 200ml dung dịch Br2 0,2M.
Hiện tượng quan sát được là
A. màu dung dịch Br2 không đổi
B. màu da cam của dung dịch brom nhạt hơn so với ban đầu
C. màu da cam của dung dịch brom đậm hơn so với ban đầu
D. màu da cam của dung dịch brom chuyển thành không màu
Câu 3: Cặp chất nào sau đây tồn tại được trong cùng một dung dịch?
A. K2CO3 và HCl
B. NaNO3 và KHCO3
C. K2CO3 và Ca(OH)2
D. KHCO3 và NaOH
Câu 4: Cho axetilen vào bình dung dịch brom dư. Khối lượng bình tăng lên a gam, a là khối lượng của
A. dung dịch brom
B. khối lượng brom
C. axetilen
D. brom và khí axetilen
Câu 5: Dãy các chất phản ứng với dung dịch NaOH là
A. CH3COOH, (C6H10O5)n
B. CH3COOC2H5, C2H5OH
C. CH3COOH, C6H12O6
D. CH3COOH, CH3COOC2H5
Câu 6: Cho natri tác dụng với rượu etylic, chất tạo thành là
A. H2, CH3CH2ONa
B. H2, NaOH
C. NaOH, H2O
D. CH3CH2ONa, NaOH
Câu 7: Một loại rượu etylic có độ rượu 15°, thể tích C2H5OH chứa trong 1 lít rượu đó là
A. 850 ml B. 150 ml C. 300 ml D. 450 ml
Câu 8: Chỉ dùng dung dịch iot và dung dịch AgNO3 trong NH3 có thể phân biệt được các chất trong mỗi dãy của dãy nào sau đây?
A. axit axetic, glucozo, saccarozo
B. xenlulozo, rượu etylic, saccarozo
C. hồ tinh bột, rượu etylic, glucozo
D. benzene, rượu etylic, glucozo
Phần tự luận (6 điểm)
Câu 9: (2 điểm) Hãy viết phương trình hóa học và ghi rõ điều kiện của các phản ứng sau:
1. Trùng hợp etilen.
2. Axit axetic tác dụng với magie.
3. Oxi hóa rượu etylic thành axit axetic.
4. Đun nóng hỗn hợp rượu etylic và axit axetic có axit sunfuric đặc làm xúc tác
Câu 10: (2 điểm) Viết các phương trình hóa học (ghi rõ điều kiện) biểu diễn những chuyển hóa sau: FeS2 → SO2 → SO3 → H2SO4 → CH3COOH
Câu 11: (2 điểm) Cho 2,24 lít (đktc) hỗn hợp khí axetilen và metan vào dung dịch brom, dung dịch brom bị nhạt màu. Sau phản ứng khối lượng dung dịch tăng 1,3g.
1. Tính khối lượng brom tham gia phản ứng.
2. Xác định thành phần % về thể tích của mỗi khí trong hỗn hợp.
(cho O=16, C=12, H=1)
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | C | B | C | C | D | A | B | C |
Câu 1:C
Phân tử của chúng có liên kết ba và liên kết đôi.
Câu 2:B
nC2H4 = 0, 025 mol ; nBr2 = 0,04 lớn hơn số mol C2H4.
Nên còn màu da cam của dung dịch brom chỉ nhạt đi, không mất màu hẳn.
Câu 3:C
NaNO3 không tác dụng với KHCO3.
Câu 4:C
Dung dịch brom dư đã tác dụng và giữ hết axetilen.
Câu 5:D
C2H5OH, ( C6H10O5 )n không phản ứng với dung dịch NaOH.
Câu 6:A
2C2H5OH + 2Na → 2CH3CH2ONa + H2
Câu 7:B
Thể tích C2H5OH = 1000.0,15 = 150 ml.
Câu 8:C
Dùng dung dịch iot nhận ra được hồ tinh bột. dung dịch AgNO3 trong NH3 có thể phân biệt được rượu etylic và glucozo.
Câu 9:
1. Trùng hợp etilen: nCH2=CH2 to, xt, p→ (-CH2-CH2-)n
2. Axit axetic tác dụng với magie: 2CH3COOH + Mg → (CH3COO)2Mg + H2
3. Oxi hóa rượu etylic thành axit axetic:
C2H5OH + O2 men giấm→ CH3COOH + H2O
4. Đun nóng hỗn hợp rượu etylic và axit axetic có axit sunfuric đặc làm xúc tác.
CH3COOH + C2H5OH to, xt⇋ CH3COOC2H5 + H2O
Câu 10:
Viết các phương trình hóa học (ghi rõ điều kiện) biểu diễn những chuyển hóa sau:
4FeS2 + 11O2 to→ 8SO2 + 2Fe2O3
2SO2 + O2 to, xt⇋ 2SO3
SO3 + H2O → H2SO4
H2SO4+ 2CH3COONa → 2CH3COOH + Na2SO4
Câu 11:
Dung dịch brom (dư) nên khối lượng dung dịch tăng bằng khối lượng C2H2 bị giữ lại tức bằng 1,3 gam.
C2H2 + 2Br2 → C2H2Br4
nC2H2 = 1,3/26 = 0,05 mol. Suy ra nBr2 = 0,05 x 2 = 0,1 mol.
Khối lượng brom tham gia phản ứng: 0,1 x 189 = 18 (gam).
Thành phần % về thể tích của C2H2 là 50%.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 6)
I. TRẮC NGHIỆM
Câu 1 : Khi cho Na dư vào rược etylic 90%, số phản ứng hóa học diễn ra là?
A. 1 B. 2
C. 3 D. 4
Câu 2 : Rượu etyÌic phản ứng được với:
A. K, MgCO3, CH3COOH .
B. CH3COOH, O2, K2CO3
C. K, CH3COOH, O2.
D. Na, O2, Mg.
Câu 3 : Cặp chất cùng tồn tại trong một dung dịch (không phản ứng với nhau) lâ
A. CH3COOH và Ca(OH)2.
B. CH3COOH và Na2CO3.
C. CH3COOH và H3PO4.
D. CH3COOH và NaOH.
Câu 4 : Trong các chất sau: Mg, Cu, MgO, KOH, Na2SO4, Na2SO3.:Dung dịch axit axetic tác được với:
A. Cu, MgO, Na2SO4, Na2SO3
B. MgO, KOH, Na2SO4, Na2SO3
C. Mg, Cụ, MgO, KOH
D. Mg, MgO, KOH, Na2SO3
Câu 5 : Khi đốt cháy một hiđrocacbon A thu được số mol CO2 bằng số mol nước. Vậy hiđrocacbon A là:
A. C2H4. B. CH4.
C. C2H2 D. C6H6.
Câu 6 : Để làm sạch khí CH4 có lẫn tạp chất khí C2H4 ta dẫn hỗn hợp khí trên qua
A. nước.
B. dung dịch HCl.
C. đụng dịch Brom.
D. dd Ca(OH)2,
Câu 7 : Dãy các hợp chất nào sau đây chỉ toàn là dẫn xuất hiđrocachon?
A. CH4, C2H4, CH3Cl
B. C6H6, C3H4, HCHO
C. C2H2, C2H5OH, C6H12
D. CH3Cl, C2H4Br2:, HCHO
Câu 8 : Khí etilen không phản ứng với chất nào sau đây
A. O2 B. CO2
C. Br2 D. H2
Câu 9 : Hóa chất dùng để phân biệt rượu etylic, axit axetic là
A. Quì tím B. Brom
C. Clo D. Nước
Câu 10 : Công thức phân tử của hợp chất A có dạng (CH2)n; tỉ khối hơi của A đối với oxi là 0,875. Công thức phân tử của A là
A. CH2 B. C2H6
C. C3H6 D. C2H4
Câu 11 : Số ml rượu etylic có trong 200 ml rượu 40 độ là
A. 80 ml B. 70 ml
C. 75 ml D. 60 ml
Câu 12 : Cho kim loại magie tác dụng với axit axetic thu được 3,36 lí khí H2. Khối lượng muối magie axetat tạo thành là
A. 20,3 B. 21,3
C. 23,3 D. 22,3
II. TỰ LUẬN
Câu 1 : Viết phương trình hóa học cho chuỗi chuyển hóa sau:
Etilen rượu etylic axit axetic etyl axetatnatri axetat axit axetic
Câu 2 : Bằng phương pháp hóa học hãy nhận biết các khí sau: CO2, CH4 và C2H4
Viết phương trình hóa học
Câu 3 : Cho 20,5 gam hỗn hợp X gồm rượu etylic và axit axetic tác dụng hết với Na dư thu được 4,48 lít khí (đktc)
Lời giải chi tiết
ĐÁP ÁN

HƯỚNG DẪN GIẢI CHI TIẾT
I. TRẮC NGHIỆM
Câu 1:
Phương pháp:
Xem lại lý thuyết bài rượu etylic trong chương trình hóa học lớp 9
Hướng dẫn giải:
Khi cho Na vào rượu etylic 90 độ, sẽ có 2 phản ứng hóa học diễn ra:
Na + H2O → NaOH + H2
Na + C2H5OH → C2H5ONa + ½ H2
Đáp án B
Câu 2:
Phương pháp:
Xem lại phần tính chất hóa học của rượu etylic
Hướng dẫn giải:
Rượu etylic phản ứng được với axit, oxi và một số kim loại
Rượu etylic có thể phản ứng được với K, CH3COOH, O2
PTHH:
C2H5OH + K → C2H5OK + ½ H2
C2H5OH + CH3COOH CH3COOC2H5 + H2O
C2H5OH + 3O2 2CO2 + 3H2O
Đáp án C
Câu 3:
Phương pháp:
Xem lại phần tính chất hóa học của axit axetic có trong chương trình hóa học lớp 9
Cặp chất có khả năng cùng tồn tại trong một dung dịch là cặp chất không phản ứng với nhau khi được cho vào cùng 1 dung dịch
Hướng dẫn giải:
Cặp chất cùng tồn tại trong 1 dung dịch là CH3COOH và H3PO4 vì chúng không phản ứng với nhau.
Các trường hợp còn lại, ta có phương trình hóa học
(A) 2CH3COOH + Ca(OH)2 → (CH3COO)2Ca + 2H2O
(B) 2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
(C) Không phản ứng
(D) CH3COOH + NaOH → CH3COONa + H2O
Đáp án C
Câu 4:
Hướng dẫn giải:
Dung dịch axit axetic có khả năng phản ứng với:
+ bazơ, oxit bazơ
+ kim loại đứng trước H trong dãy hoạt động hóa học
+ Muối của gốc axit yếu hơn CH3COOH
Hướng dẫn giải:
Dung dịch axit axetic có khả năng phản ứng được với: Mg, MgO, KOH, Na2SO3
Ta có phương trình hóa học:
Mg + 2 CH3COOH → (CH3COO)2Mg + H2
MgO + 2 CH3COOH → (CH3COO)2Mg + H2O
KOH + CH3COOH → CH3COOK +H2O
Na2SO3 + CH3COOH → CH3COONa + SO2 + H2O
Đáp án D
Câu 5:
Phương pháp:
Viết phương trình hóa học và nhận định đán án đúng
Hướng dẫn giải:
Ta có phương trình hóa học:
(A) C2H4 + 3 O2 ..2CO2 + 2H2O
(B) CH4 + 2 O2 CO2 + 2H2O
(C) C2H2 + 5/2 O2 2CO2 + H2O
(D) C6H6 + 15/2 O2 6CO2 + 3H2O
Đáp án A
Câu 6:
Phương pháp:
Xem lại phần tính chất hóa học của CH4 và C2H4
Hướng dẫn giải:
Để làm sạch khí CH4 có lẫn C2H4, ta dẫn hỗn hợp khí qua nước brom, khi đó C2H4 tham gia phản ứng sẽ bị giữ lại. Sau đó ta sẽ thu được khí CH4 tinh khiết
C2H4 + Br2 → C2H4Br2
Đáp án C
Câu 7:
Phương pháp:
Các chất thuộc loại dẫn xuất hidro cacbon có đặc điểm là: Ngoài C, trong dẫn xuất hidro cacbon còn có các nguyên tố khác như: O, Clo, S, F, I, Br, …
Hướng dẫn giải:
- Đáp án A sai vì CH4 và C2H4 là hidro cacbon
- Đáp án B sai vì C6H6 và C3H4 là hidro cacbon
- Đáp án C sai vì C2H2 và C6H12 là hidro cacbon
Đáp án D
Câu 8:
Phương pháp:
Xem lại tính chất hóa học của khí etilen.
Hướng dẫn giải:
Khí etilen không tác dụng được với khí CO2.
Đáp án B
Câu 9:
Hướng dẫn giải:
Xem lại tính chất hóa học của rượu etylic và axit axetic. Ta sử dụng quỳ tím để phân biệt 2 chất này. Vì axit axetic có thể làm quỳ tím chuyển sang màu hồng, còn rượu etylic thì không.
Đáp án A
Câu 10:
Phương pháp:
Từ tỉ khối A so với oxi => MA => n => CTPT của A
Hướng dẫn giải:
MA = 0,875 * MO2 = 0,875 * 32 = 28 (gam/mol)
Mặt khác A có CTPT là (CH2)n
=> 14n = 28 => n =2
CTPT của A là C2H4
Đáp án D
Câu 11:
Phương pháp:
Rượu x độ là rượu có chứa x ml rượu trong 100ml dung dịch
Hướng dẫn giải:
Theo đề bài đang xét là rượu 40 độ
=> 100 ml rượu 40 độ sẽ có chứa 40 ml rượu nguyên chất
Vậy 200 ml rượu 40 độ sẽ có chứa a ml rượu nguyên chất
Ta có: a = 40 * 200 : 100 = 80 ml
Đáp án A
Câu 12:
Phương pháp:
Viết phương trình phản ứng hóa học
Tính nH2 => n(CH3COO)2Mg => m(CH3COO)2Mg
Hướng dẫn giải:
Theo đề bài ta có phương trình hóa học là:
2 CH3COOH + Mg → (CH3COO)2Mg + H2
nH2 = 3,36 : 22,4 = 0,15 mol
Theo phương trình hóa học ta có
1 mol (CH3COO)2Mg => 1 mol H2
a mol (CH3COO)2Mg => 0,15 mol H2
=> a = 0,15 (mol)
m(CH3COO)2Mg = 0,15 *(59 * 2+ 24) = 21, 3 (gam)
Đáp án B
II. TỰ LUẬN
Câu 1:
Phương pháp:
Xem lại tính chất hóa học của phần hidro cacbon và dẫn xuất hidro cacbon
Hướng dẫn giải:
(1) C2H4 + H2O → C2H5OH
(2) C2H5OH + O2 → CH3COOH + H2O
(3) CH3COOH + C2H5OH → CH3COOC2H5 + H2O
(4) CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
(5) CH3COONa + HCl → CH3COOH + NaCl
Câu 2:
Phương pháp:
Xem lại tính chất hóa học của CH4 và C2H4
Hướng dẫn giải:
- Cho lần lượt 3 khí CH4, C2H4, CO2 lần lượt đi qua dung dịch Ca(OH)2. Khí nào làm Ca(OH)2 xuất hiện kết tủa, đó chính là CO2. Ta có phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3 + H2O
- Vậy 2 khí còn lại là : CH4 và C2H4
Cho lần lượt 2 khí này đi qua dung dịch Brom. Khí nào làm nhạt màu nước brom, đó chính là C2H4. Ta có phương trình phản ứng:
C2H4 + Br2 → C2H4Br2
Từ phương pháp trên ta có thể nhận biết được 3 khí: CH4, C2H4, CO2
Câu 3:
Phương pháp:
a, Viết phương trình hóa học => gọi nC2H5OH, nCH3COOH lần lượt là x,y
=> Tính số mol H2, và từ phương trình tìm ra x, y
=> Thành phần % khối lượng mỗi chất
b, Viết phương trình phản ứng este hóa
=> Từ phương trình suy ra lượng este lý thuyết
=> Với H = 90% suy ra lượng este thực tế.
Hướng dẫn giải:
a, Theo đề bài ta có phương trình hóa học như sau:
C2H5OH + Na → C2H5ONa + ½ H2 (1)
CH3COOH + Na → CH3COONa + ½ H2 (2)
nH2 = V/22,4 = 4,48 : 22,4 = 0,2 (mol)
Gọi nC2H5OH, nCH3COOH lần lượt là x, y (mol)
Theo đề bài, khối lượng của X nặng 20,5 gam
=> x * MC2H5OH + y * MCH3COOH = 20,5
=> x * 46 + y * 60 = 20,5 (I)
Xét phương trình hóa học ta có:
(1) n H2 = ½ n C2H5OH = x/2 (mol)
(2) n H2 = ½ n CH3COOH = y/2 (mol)
Vậy x/2 + y/2 = 0,2 (II)
Từ I và II ta có hệ phương trình
%m C2H5OH =
%m CH3COOH = 100% - 56,1% = 43,9%
b, Theo đề bài ta có phương trình hóa học:
C2H5OH + CH3COOH CH3COOC2H5 + H2O (3)
Theo phương trình hóa học ta thấy
=> Phản ứng này, C2H5OH dư, CH3COOH hết.
nEste tính theo CH3COOH
(1) n Este (lý thuyết) = nCH3COOH = 0,15 (mol)
nEste (thực tế) = nEste (lý thuyết) * H%
= 0,15 * 90% = 0,135 (mol)
mEste thực tế thu được là:
0,135 * (12 * 4 + 1 * 8 + 16 * 2) = 11,88 (gam).
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 7)
Câu 1:
Viết phương trình hóa học thực hiện chuỗi tiến hóa sau:
C2H4 C2H5OH CH3COOH CH3COONa CH3COOH
Câu 2:
a, Hợp chất hữu cơ là gì?
b, Cho các chất: C6H12O6, CaCO3, C4H10, CO2, NaNO3, CH3NO2, NaHCO3.
Chất nào là chất hữu cơ trong các chất trên?
Câu 3:
Đốt cháy hoàn toàn 11,2 lít khí metan. Hãy tính thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành. Biết các thể tích khí đo ở điều kiện tiêu chuẩn
Câu 4:
Điền từ thích hợp “có” hoặc “không” vào các cột sau:
|
|
Liên kết đôi |
Làm mất màu dung dịch brom |
Phản ứng trùng hợp |
Tác dụng với oxi
|
|
Metan |
|
|
|
|
|
Etilen |
|
|
|
|
Câu 5:
a. Axit axetic có thể tác dụng được với những chất nào trong các chất sau đây: ZnO, KOH, Cu, Na2SO4, C2H5OH? Viết các phương trình hóa học (nếu có)
b. Cho 13,8 gam C2H5OH tác dụng với natri (dư) thu được bao nhiêu gam muối và bao nhiêu lít khí hidro (đktc)
Lời giải chi tiết
Câu 1:
Phương pháp giải:
Xem lại phần tính chất hóa học của hidrocacbon và dẫn xuất hidrocacbon có trong chương trình hóa học lớp 9
Hướng dẫn giải:
C2H4 + H2O C2H5OH
C2H5OH + O2 CH3COOH + H2O
CH3COOH + NaOH → CH3COONa + H2O
CH3COONa + HCl → CH3COOH + NaCl
Câu 2:
Phương pháp giải:
Xem lại phần định nghĩa hợp chất hữu cơ. Dựa vào định nghĩa để các định đâu là chất hữu cơ có trong dãy chất đề bài cho.
Hướng dẫn giải:
Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, Na2CO3 và muối cacbonat, cacbua kim loại như CaC2,..)
Trong dãy chất trên, các chất là hợp chất hữu cơ là: C6H12O6, C4H10, C2H6O, CH3NO2.
Câu 3:
Phương pháp giải:
Tính số mol khí metan
Viết phương trình đốt cháy
Dựa vào phương trình => số mol CO2 tạo thành và số mol O2 phản ứng
=> Thể tích khí CO2 và O2
Hướng dẫn giải:
n CH4 = V : 22,4 = 11,2 : 22,4 = 0,5 (mol)
Ta có phương trình hóa học:
CH4 + 2O2 CO2 + 2H2O (1)
PT 1 2 1
mol 0,5 x y
Từ (1) => 0,5 * 2 = x * 1 => x = 1 (mol)
=> Số mol oxi phản ứng là 1 mol
V O2 = 1 * 22,4 = 22,4 (lít)
Từ (1) => 0,5 * 1 = y * 1 => y = 0,5 (mol)
=> Số mol CO2 tạo thành là 0,5 mol
V CO2 = 0,5 * 22,4 = 11,2 (lít)
Câu 4:
Phương pháp giải:
Xem lại phần tính chất hóa học của metan (CH4) và Etilen (C2H4)
Hướng dẫn giải:
|
|
Liên kết đôi |
Làm mất màu dung dịch brom |
Phản ứng trùng hợp |
Tác dụng với oxi
|
|
Metan |
không |
không |
không |
có |
|
Etilen |
có |
có |
có |
có |
Các phương trình diễn ra:
CH4 + 2O2 CO2 + 2H2O
C2H4 + 3O2 2CO2 + 2H2O
C2H4 + Br2 → C2H4Br2
n CH2=CH2 (CH2-CH2)n
Câu 5:
Phương pháp giải:
a, Xem lại phần tính chất hóa học của axit axetic có trong chương trình hóa học lớp 9
b, Tính n C2H5OH
Viết phương trình phản ứng => số mol muối, và số mol khí H2
=> Khối lượng muối và thể tích khí H2 tạo thành.
Hướng dẫn giải:
a. Axit axetic có khả năng tác dụng được với các chất là: ZnO, KOH, C2H5OH
Phương trình phản ứng:
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
CH3COOH + KOH → CH3COOK + H2O
CH3COOH + C2H5OH CH3COOC2H5 + H2O
b. n C2H5OH = 13,8 : 46 = 0,3 (mol)
Ta có phương trình hóa học:
C2H5OH + Na → C2H5ONa +1/2 H2 (1)
PT 1 1 ½
mol 0,3 x y
Từ phương trình (1) ta thấy: 0,3 * 1 = x * 1 => x = 0,3 (mol)
=> Số mol muối tạo thành sau phản ứng là 0,3 mol
m C2H5ONa = 0,3 * (12 * 2 + 5 + 16 + 23) = 20,4 (gam)
Từ phương trình (1) ta lại có: 0,3 * ½ = y * 1 => y = 0,15 (mol)
=> Số mol khí H2 tạo thành sau phản ứng là 0,15 mol
=> V H2 = 0,15 * 22,4 = 3,36 (lít)
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 8)
I. TRẮC NGHIỆM (5,0 điểm)
Câu 1 : Dãy nào được sắp xếp theo chiều tính kim loại tăng dần?
A. Al, Mg, Na, K.
B. Al, Na, Mg, K.
C. K, Na, Mg, Al.
D. Mg, K, Na, Al.
Câu 2 : Khi xăng dầu chảy tràn ra mặt đất gây cháy thì những phương pháp dập tắt phù hợp là
A. dùng nước phun vào đám cháy, dùng chăn ướt.
B. dùng cát, phun nước vào đám cháy.
C. dùng đất, cát phủ kín đám cháy, dùng bình chữa cháy.
D. dùng chăn ướt, phun nước vào đám cháy.
Câu 3 : Đâu là công thức cấu tạo thu gọn đúng của rượu etylic?
A. CH3-O-CH3.
B. CH3-CH2-OH.
C. CH3-OH.
D. HO-CH2-CH(OH)-CH2OH.
Câu 4 : Thành phần chính của khí thiên nhiên là
A. Etlien.
B. Metan.
C. Cacbon đioxit.
D. Axetilen.
Câu 5 : Rượu etylic có thể phản ứng với chất nào dưới đây?
A. Oxi, cacbon đioxit.
B. Axit axetic, natri oxit.
C. Oxi, natri, axit axetic.
D. Natri hiđroxit, axit axetic.
Câu 6 : Cho m gam rượu etylic tác dụng với natri vừa đủ. Sau khi phản ứng xảy ra hoàn toàn thu được 5,6 lít khí H2 (đktc). Giá trị của m là
A. 5,75.
B. 46,0.
C. 23,0.
D. 13,8.
Câu 7 : Dùng thuốc thử nào để phân biệt khí metan với khí etilen?
A. Dung dịch nước vôi trong.
B. Dung dịch bari hiđroxit.
C. Dung dịch brom.
D. Dung dịch natri clorua.
Câu 8 : Khi bạn muốn pha cồn 70o cho việc sát khuẩn dụng cụ thí nghiệm mà trong phòng thí nghiệm chỉ có cồn 90o thì bạn có thể pha được bao nhiêu ml cồn 70o từ 50,0 ml cồn 90o?
Biết công thức tính độ rượu là
A. 70,0 ml.
B. 45,0 ml.
C. 64,3 ml.
D. 54,3 ml.
Câu 9 : Dãy nào chỉ gồm các hợp chất hữu cơ?
A. C2H6, CO2, CH3Cl, CH4.
B. CH4, C2H4, C2H6O, C2H4O2.
C. Na2CO3, C3H8, C2H4Br2, CO.
D. NaHCO3, C6H6, C2H4O2, CO2.
Câu 10 : Để sản xuất giấm ăn, người ta thường dùng phương pháp lên men dung dịch rượu etylic loãng. Phương trình hóa học nào biểu diễn đúng phản ứng lên men trên?
A. C2H5OH + 3O2 2CO2 + 3H2O.
B. C2H5OH + O2 CH3COOH + H2O.
C. 2C4H10 + 5O2 4CH3COOH + 2H2O.
D. nCH2=CH2 (-CH2-CH2-)n.
Câu 11 : Đốt cháy hoàn toàn 8,96 lít hỗn hợp X gồm metan và etilen thu được 15,68 lít CO2. Thể tích các khí đo ở cùng điều kiện về nhiệt độ và áp suất. Thành phần % theo thể tích của metan là
A. 60%.
B. 25%.
C. 75%.
D. 50%.
Câu 12 : Trên nhãn chai cồn ghi là cồn 90o có nghĩa là
A. trong 190ml hỗn hợp có 90 ml là rượu etylic.
B. trong 100 ml hỗn hợp có 90 ml là nước còn lại 10 ml là rượu etylic.
C. trong 190 ml hỗn hợp có 100 ml là rượu etylic.
D. trong 100 ml hỗn hợp có 90 ml rượu etylic.
Câu 13 : Dãy nào chỉ gồm những hiđrocacbon?
A. C2H4Br2, C6H6, C2H6.
B. C2H4O2, C2H2, CH3Cl.
C. C2H6O2, CH4, C2H4.
D. C2H2, C2H4, CH4.
Câu 14 : Cho sơ đồ phản ứng: CH3COOH + C2H5OH X + H2O. Vậy X là chất nào dưới đây?
A. CH3COOC2H5.
B. CH3CH2C2H5.
C. CH3OC2H5.
D. CH3COC2H5.
Câu 15 : Cho 60 gam axit axetic tác dụng với 92 gam rượu etylic thu được 55 gam etyl axetat. Hiệu suất phản ứng este hóa là
A. 62,5%.
B. 65,5%.
C. 75,3%.
D. 60,2%.
Câu 16 : Dùng thuốc thử nào để phân biệt rượu etylic và axit axetic?
A. Quỳ tím.
B. Natri.
C. Cacbon đioxit.
D. Bạc nitrat.
Câu 17 : Phát biểu nào đúng về ứng dụng của etilen?
A. Sản xuất nhựa PE, PVC; pha nước hoa, pha sơn.
B. Pha sơn, pha vecni, sản xuất rượu etylic.
C. Pha dược phẩm, sản xuất rượu etylic.
D. Sản xuất nhựa PE, PVC, axit axetic; kích thích quả mau chín.
Câu 18 : Cho sơ đồ phản ứng sau: C2H4 + Br2 ⟶ X. Vậy X là chất nào dưới đây?
A. C2H4Br2.
B. C2H4Br.
C. C2H3Br.
D. C2H5Br.
Câu 19 : Đốt cháy hoàn toàn 6 gam hợp chất hữu cơ X gồm 3 nguyên tố C, H, O thu được 6,72 lít CO2 (đktc) và 7,2 gam H2O. Biết khối lượng mol của X là 60 g/mol. CTPT của X là
A. C2H4O2.
B. C4H10O.
C. C2H6O.
D. C3H8O.
Câu 20 : Phương trình hóa học nào thể hiện đúng tính chất phản ứng thế?
A. C2H4 + 3O2 2CO2 + 2H2O.
B. C2H4 + Br2 ⟶ C2H4Br2.
C. CH4 + 2O2 CO2 + 2H2O.
D. CH4 + Cl2 CH3Cl + HCl.
II. TỰ LUẬN (5,0 điểm)
Câu 1 : (1,0 điểm)
Viết công thức cấu tạo đầy đủ của:
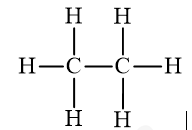
a) Etan: C2H6.
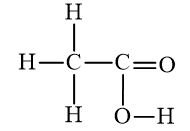
b) Axit axetic: C2H4O2.
Câu 22 : (1,5 điểm)
Viết PTHH hoàn thành chuỗi phản ứng sau. Ghi rõ điều kiện (nếu có)
Etilen Rượu etylic Axit axetic Etyl axetat
Câu 23 : (2,5 điểm)
Đốt cháy hoàn toàn 5,6 lít etilen trong khí oxi dư. (Thể tích các khí đo ở đktc).
a) Tính thể tích khí oxi cần cho phản ứng cháy.
b) Tính thể tích khí CO2 thu được (đktc).
Học sinh được sử dụng bảng tuần hoàn các nguyên tố hóa học
--- HẾT ---
Lời giải chi tiết
I. TRẮC NGHIỆM
Câu 1
Phương pháp:
Dựa vào kiến thức về dãy hoạt động hóa học của kim loại.
Cách giải:
Dãy sắp xếp các kim loại theo chiều tính kim loại tăng dần là Al, Mg, Na, K.
Chọn A.
Câu 2
Phương pháp:
Dựa vào tính chất vật lí của xăng, dầu.
Cách giải:
Khi xăng dầu chảy tràn ra mặt đất gây cháy thì những phương pháp dập tắt phù hợp là dùng đất, cát phủ kín đám cháy, dùng bình chữa cháy.
Không dùng nước phun vào đám cháy vì xăng, dầu không tan trong nước sẽ làm cho xăng, dầu loang ra rộng hơn gây khó khắn trong việc dập tắt đám cháy.
Chọn C.
Câu 3
Phương pháp:
Dựa vào kiến thức về rượu etylic.
Cách giải:
Công thức cấu tạo thu gọn đúng của rượu etylic là CH3-CH2-OH.
Chọn B.
Câu 4
Phương pháp:
Dựa vào kiến thức về khí thiên nhiên.
Cách giải:
Thành phần chính của khí thiên nhiên là khí metan.
Chọn B.
Câu 5
Phương pháp:
Dựa vào tính chất hóa học của rượu etylic.
Cách giải:
Rượu etylic có thể phản ứng với dãy chất gồm oxi, natri và axit axetic.
C2H5OH + 3O2 2CO2 + 3H2O
2C2H5OH + 2Na ⟶ 2C2H5ONa + H2
C2H5OH + CH3COOH
CH3COOC2H5 + H2O
Chọn C.
Câu 6
Phương pháp:
PTHH: 2C2H5OH + 2Na ⟶ 2C2H5ONa + H2
Dựa vào PTHH ⟹ nC2H5OH ⟹ m.
Cách giải:
PTHH: 2C2H5OH + 2Na ⟶ 2C2H5ONa + H2
Theo PTHH ⟹
Vậy m = 0,5.46 = 23 gam.
Chọn C.
Câu 7
Phương pháp:
Dựa vào tính chất hóa học đặc trưng của metan và etilen.
Cách giải:
Dùng dung dịch brom có thể phân biệt khí metan và khí etilen.
Khí etilen làm mất màu dung dịch brom.
PTHH: C2H4 + Br2 ⟶ C2H4Br2.
Khí metan không hiện tượng.
Chọn C.
Câu 8
Phương pháp:
Từ 50 ml cồn 90o ⟹ Thể tích rượu etylic nguyên chất.
⟹ Thể tích dung dịch cồn 70o.
Cách giải:
Thể tích rượu etylic nguyên chất trong 50 ml cồn 90o là
Vậy thể tích dung dịch cồn 70o có thể pha được từ 50 ml cồn 90o là
Chọn C.
Câu 9
Phương pháp:
Hợp chất hữu cơ là hợp chất của cacbon, chỉ có một số ít không là hợp chất hữu cơ (như CO, CO2, H2CO3, các muối cacbonat kim loại…)
Cách giải:
Dãy gồm các hợp chất hữu cơ là CH4, C2H4, C2H6O, C2H4O2.
Chọn B.
Câu 10
Phương pháp:
Dựa vào kiến thức về axit axetic (giấm ăn).
Cách giải:
Phương trình hóa học lên men giấm là C2H5OH + O2 CH3COOH + H2O.
Chọn B.
Câu 11
Phương pháp:
Gọi số mol của CH4 và C2H4 trong X lần lượt là x và y (mol)
Lập hệ hai phương trình dựa vào số mol X và số mol CO2 ⟹ x và y.
⟹
Cách giải:
Gọi số mol của CH4 và C2H4 trong X lần lượt là x và y (mol)
⟹ nX = x + y = 0,4 (1)
CH4 + 2O2 CO2 + 2H2O
C2H4 + 3O2 2CO2 + 2H2O
Theo PTHH ⟹ nCO2 = x + 2y = 0,7 (2)
Từ (1) và (2) ⟹ x = 0,1 và y = 0,3.
Vậy
Chọn B.
Câu 12
Phương pháp:
Dựa vào kiến thức về độ rượu.
Cách giải:
Trên nhãn chai cồn ghi là cồn 90o có nghĩa là trong 100 ml hỗn hợp có 90 ml rượu etylic.
Chọn D.
Câu 13
Phương pháp:
Hiđrocacbon là hợp chất hữu cơ mà trong phân tử chỉ chứa 2 nguyên tố là C và H.
Cách giải:
Dãy chất gồm các hiđrocacbon là C2H2, C2H4, CH4.
Chọn D.
Câu 14
Phương pháp:
Dựa vào tính chất hóa học của ancol etylic và axit axetic.
Cách giải:
PTHH: CH3COOH + C2H5OH CH3COOC2H5 + H2O
Vậy X là CH3COOC2H5.
Chọn A.
Câu 15
Phương pháp:
Xét tỉ lệ số mol CH3COOH và C2H5OH ⟹ chất phản ứng hết, chất còn dư (khi hiệu suất phản ứng đạt 100%).
⟹ Khối lượng etyl axetat thu được theo lý thuyết (tính số mol theo chất phản ứng hết).
⟹ Hiệu suất phản ứng là
Cách giải:
nCH3COOH = 1 mol ; nC2H5OH = 2 mol.
PTHH: CH3COOH + C2H5OH CH3COOC2H5 + H2O
Nhận thấy nCH3COOH/1 = 1 < 2 = nC2H5OH/1
⟹ CH3COOH phản ứng hết và C2H5OH còn dư (khi hiệu suất phản ứng đạt 100%).
Theo PTHH ⟹ netylaxetat(LT) = nCH3COOH = 1 mol ⟹ metylaxetat(LT) = 88 gam.
Vậy hiệu suất phản ứng là
Chọn A.
Câu 16
Phương pháp:
Dựa vào tính chất hóa học đặc trưng của rượu etylic và axit axetic.
Cách giải:
Có thể sử dụng quỳ tím để phân biệt rượu etylic và axit axetic.
- Axit axetic làm quỳ tím hóa đỏ.
- Rượu etylic không làm đổi màu quỳ tím.
Chọn A.
Câu 17
Phương pháp:
Dựa vào kiến thức về ứng dụng của etilen.
Cách giải:
Ứng dụng của etilen là sản xuất nhựa PE, PVC, axit axetic; kích thích quả mau chín.
Chọn D.
Câu 18
Phương pháp:
Dựa vào tính chất hóa học của etilen.
Cách giải:
PTHH: C2H4 + Br2 ⟶ C2H4Br2.
Vậy chất X là C2H4Br2.
Chọn A.
Câu 19
Phương pháp:
Gọi công thức phân tử của X là CxHyOz.
PTHH:
Theo PTHH ⟹ x và y ⟹ z (Do M = 60) ⟹ CTPT của X.
Cách giải:
nX = 6/60 = 0,1 mol ; nCO2 = 6,72/22,4 = 0,3 mol ; nH2O = 7,2/18 = 0,4 mol.
PTHH:
Theo PTHH ⟹
Lại có MX = 12x + y + 16z = 60 ⟹ z = 1.
Vậy công thức của X là C3H8O.
Chọn D.
Câu 20
Phương pháp:
Dựa vào kiến thức về phản ứng thế trong hóa học hữu cơ.
Cách giải:
PTHH thể hiện đúng tính chất của phản ứng thế là CH4 + Cl2 CH3Cl + HCl.
Chọn D.
II. TỰ LUẬN
Câu 1
Phương pháp:
Dựa vào kiến thức về cấu trúc phân tử hợp chất hữu cơ.
Cách giải:
|
Công thức phân tử |
C2H6 |
C2H4O2 |
|
Công thức cấu tạo đầy đủ |
 |
 |
Câu 2
Phương pháp:
Dựa vào tính chất hóa học của các hợp chất hữu cơ đã học.
Cách giải:
Chuỗi phản ứng:
C2H4 C2H5OH CH3COOH CH3COOC2H5
(1) C2H4 + H2O C2H5OH
(2) C2H5OH + O2 CH3COOH + H2O
(3) CH3COOH + C2H5OH CH3COOC2H5 + H2O
Câu 3
Phương pháp:
PTHH: C2H4 + 3O2 2CO2 + 2H2O
Dựa vào PTHH ⟹ nO2 và nCO2 ⟹ VO2 và VCO2.
Cách giải:
nC2H4 = 5,6/22,4 = 0,25 mol.
PTHH: C2H4 + 3O2 2CO2 + 2H2O
a) Theo PTHH ⟹ nO2 = 3nC2H4 = 0,75 mol.
⟹ VO2 = 0,75.22,4 = 16,8 lít.
b) Theo PTHH ⟹ nCO2 = 2nC2H4 = 0,5 mol.
⟹ VCO2 = 0,5.22,4 = 11,2 lít.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 9)
Câu 1 : (3 điểm)
Viết phương trình hóa học của phản ứng xảy ra trong các trường hợp sau (ghi rõ điều kiện nếu có).
a) K2CO3 + BaCl2 →
b) NaHCO3 + HNO3 →
c) Si + O2 →
d) CH4 + Cl2
e) CH2 = CH2 + H2 →
f) CH2 = CH2 + H2O →
Câu 2 : (3 điểm)
Cho 4 chất sau: C2H5OH, CaCO3, CH2 = CH – CH3, CH3 – O – CH3
a) Chất nào là chất hữu cơ?
b) Chất nào tác dụng được với Na? Viết phương trình hóa học.
c) Chất nào làm mất màu dung dịch Br2?
d) Nêu 3 ứng dụng của C2H5OH.
Câu 3 : (2 điểm)
Hỗn hợp X gồm metan và etilen. Cho 4,48 lít X (đktc) lội qua dung dịch Br2 dư thì có 22,4 gam Br2 tham gia phản ứng.
a) Tính phần trăm thể tích các khí trong X.
b) Tính thể tích O2 (đktc) cần để đốt cháy hết 4,48 lít X (đktc) trên.
Câu 4 : (1 điểm)
Hãy trình bày phương pháp hóa học phân biệt 2 chất lỏng ancol etylic và nước đựng trong các lọ riêng biệt mất nhãn. Viết phương trình hóa học của phản ứng xảy ra.
Câu 5 : (1 điểm)
Nhiệt phân hoàn toàn hỗn hợp gồm 0,03 mol CaCO3 và 0,04 mol NaHCO3 thu được m gam chất rắn.
Tính m.
Lời giải chi tiết
Câu 1
Phương pháp:
Dựa vào tính chất hóa học của các hợp chất đã học trong chương trình hóa 9.
Cách giải:
a) K2CO3 + BaCl2 → BaCO3 ↓ + 2KCl
b) NaHCO3 + HNO3 → NaNO3 + CO2 ↑ + H2O
c) Si + O2 SiO2
d) CH4 + Cl2 CH3Cl + HCl
e) CH2 = CH2 + H2 CH3 – CH3
f) CH2 = CH2 + H2O CH3 – CH2 – OH
Câu 2
Phương pháp:
Dựa vào kiến thức về hợp chất hữu cơ và tính chất hóa học, ứng dụng của các hợp chất hữu cơ đã học.
Cách giải:
a) Hợp chất hữu cơ là hợp chất của cacbon, chỉ có một số ít không là hợp chất hữu cơ (như CO, CO2, H2CO3, các muối cacbonat kim loại…)
Hợp chất là hợp chất hữu cơ là C2H5OH, CH2 = CH – CH3, CH3 – O – CH3.
b) Hợp chất tác dụng với Na là C2H5OH.
PTHH: 2C2H5OH + 2Na → 2C2H5ONa + H2 ↑
c) Chất làm mất màu dung dịch Br2 là CH2 = CH – CH3.
PTHH: CH2 = CH – CH3 + Br2 → CH2Br – CHBr – CH3
d) 3 ứng dụng của C2H5OH là
- Ethanol là một trong những nguyên liệu để tạo ra đồ uống có cồn mà hằng ngày chúng ta vẫn hay sử dụng như bia, rượu,…
- Etanol dùng để điều chế một số hợp chất hữu cơ như axit axetic, etyl axetat,…
- Etanol được dùng làm dung môi hoặc chất pha để pha dược phẩm, nước hoa,…
Câu 3
Phương pháp:
Hỗn hợp X có etilen phản ứng với dung dịch brom.
Dựa vào phản ứng cộng giữa etilen và brom
⟹ nC2H4 ⟹ %VC2H4 ⟹ %VCH4.
Dựa vào phản ứng đốt cháy X ⟹ nO2 ⟹ VO2.
Cách giải:
a)
nX = nCH4 + nC2H4 = 4,48/22,4 = 0,2 (mol).
nBr2 = 22,4/160 = 0,14 (mol).
PTHH: C2H4 + Br2 → C2H4Br2
Theo PTHH ⟹ nC2H4 = nBr2 = 0,14 (mol).
b)
Hỗn hợp X gồm C2H4 0,14 (mol) và CH4 0,06 (mol).
PTHH:
C2H4 + 3O2 2CO2 + 2H2O
CH4 + 2O2 CO2 + 2H2O
Theo PTHH ⟹ nO2 = 3nC2H4 + 2nCH4 = 0,54 (mol).
Vậy VO2 = 0,54.22,4 = 12,096 (lít).
Câu 4
Phương pháp:
Dựa vào tính chất hóa học đặc trưng của ancol etylic và nước.
Cách giải:
Đem đốt cháy 2 chất lỏng:
- Chất lỏng cháy: ancol etylic.
PTHH: C2H5OH + 3O2 2CO2 + 3H2O
- Chất lỏng không cháy: nước.
Câu 5
Phương pháp:
CaCO3 CaO + CO2 ↑
2NaHCO3 Na2CO3 + CO2 ↑ + H2O
Cách giải:
PTHH:
CaCO3 CaO + CO2 ↑
Theo PTHH ⟹ nCaO = nCaCO3 = 0,03 (mol)
⟹ mCaO = 0,03.56 = 1,68 (g).
2NaHCO3 Na2CO3 + CO2 ↑ + H2O
Theo PTHH ⟹ nNa2CO3 = nNaHCO3/2 = 0,02 (mol)
⟹ mNa2CO3 = 0,02.106 = 2,12 (g).
Chất rắn thu được sau phản ứng gồm CaO và Na2CO3.
⟹ m = 1,68 + 2,12 = 3,8 (g).
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 10)
Câu 1 : Nếu hiện tượng và viết phương trình hóa học cho các thí nghiệm sau:
a) Dẫn khí axetilen qua ống thủy tinh đầu vuốt nhọn rồi đốt cháy khí axetilen thoát ra.
b) Dẫn khí etilen qua dung dịch brom màu da cam.
Câu 2 : Viết phương trình hóa học biểu diễn các chuyển đổi sau (Ghi rõ điều kiện của các phản ứng nếu có)
Câu 3 : Khi xác định công thức của các chất hữu cơ A và B, người ta thấy công thức phân tử A là C2H6O, còn công thức phân tử của B là C2H4O2. Để chứng minh A là rượu etylic, B là axit axetic cần phải làm thêm những thí nghiệm nào? Viết các phương trình phản ứng hóa học minh họa (nếu có).
Câu 4 : Theo kinh nghiệm dân gian truyền lại: Khi côn trùng (ong, kiến...) đốt, ta thường lấy nước vôi bôi vào vết đốt thì vết thương sẽ mau lành và giảm cảm giác ngứa rát. Em hãy giải thích vì sao khi bôi nước vôi vào chỗ côn trùng đốt sẽ đỡ đau? Viết phương trình phản ứng hóa học minh họa (nếu có)
Câu 5 : Đốt cháy 6 gam chất hữu cơ A, thu được 8,96 lít CO2 (ở đktc) và 10,8 gam H2O.
a) Trong chất hữu cơ A có những nguyên tố nào?
b) Biết tỉ khối của A so với hidro là 15. Tìm công thức phân tử và gọi tên chất hữu cơ A.
c) Viết công thức cấu tạo của A và cho biết A có làm mất màu dung dịch brom không? Vì sao?
d) Viết phương trình hóa học của A với clo khi có ánh sáng
(Cho: H = 1; C = 12; O =16)
-------------HẾT--------------
Lời giải chi tiết
Câu 1:
Phương pháp:
Dựa vào kiến thức được học về axetilen và etilen trong sgk hóa 9
Hướng dẫn giải:
a) Hiện tượng: Axetilen cháy trong khí với ngọn lửa sáng, tỏa nhiều nhiệt.
PTHH: 2C2H2(k) + 5O2(k) 4CO2 (k) + 2H2O (h)
b) Hiện tượng: Dung dịch brom bị mất màu da cam
PTHH: CH ≡ CH (k) + Br2 (dd) → CHBr2 − CH2Br (l)
màu da cam không màu
Câu 2:
Phương pháp:
Dựa vào kiến thức được học về chương 5: dẫn xuất của hidrocacbon - polime
Hướng dẫn giải:
Phương trình hóa học xảy ra các phản ứng là:
Câu 3:
Phương pháp:
Chứng minh A là ancol etylic, lấy chất phản ứng với A để chứng minh có nhóm -OH
Chứng minh B là axit axetic,lấy chất phản ứng với B để chứng minh có nhóm -COOH
Hướng dẫn giải:
Cho A tác dụng với natri nếu có sủi bọt khí ta chứng minh được A có nhóm OH, vậy A là rượu etylic:
PTHH: 2C2H5OH + 2Na → 2C2H5ONa + H2↑
Để chứng minh B là axit axetic, ta cho mẩu quỳ tím vào chất B, nếu quỳ tím chuyển sang màu đỏ → B là axit axetic.
Chú ý: Để chứng minh B là axit axetic ta có thể dùng kim loại Mg, Zn...hoặc muối cacbonat hoặc hòa tan oxit kim loại. Sau đó viết PTHH xảy ra
Câu 4:
Phương pháp:
Dựa vào kiến thức hiểu biết thực tế
Hướng dẫn giải:
Do trong nọc ong, kiến và một số côn trùng khác có axit fomic. Nước vôi là bazơ, nên trung hòa axit làm ta đỡ đau.
PTHH: 2HCOOH + Ca(OH)2 → (HCOO)2Ca + 2H2O
Câu 5:
Phương pháp:
a) Dựa vào số mol CO2 tính được khối lượng C trong A
Dựa vào khối lượng H2O tính được khối lượng H trong A
Nếu mA = mC + mH thì A chỉ chứa nguyên tố C và H
Nếu mA > mC + mH thì A chứa các nguyên tố là C, H và O
b) Tìm công thức đơn giản nhất của A, sau đó có tỉ khối của A với H2 tìm được phân tử khối của A
có phân tử khối suy ra được CTPT của A
c) Viết CTCT của A, nếu A có chứa liên kết đôi, ba thì sẽ làm mất màu dd nước brom, còn nếu A chỉ chứa liên kết đơn thì sẽ không làm mất màu dd nước Br2
d) Dựa vào phản ứng thế của metan với Cl2 viết tương tự
Hướng dẫn giải:
Số mol của CO2 ở đktc là:
Số mol của H2O là:
Khối lượng C có trong A là:
mC = 12×nCO2 = 12×0,4 = 4,8 (g)
Khối lượng H có trong A là:
mH = 2 ×nH2O = 2×0,6 = 1,2 (g)
Ta thấy mC + mH = 4,8 + 1,2 = 6 = mA
Vậy công thức phân tử của hidrocacbon A chỉ chứa nguyên tố C và H
b) Gọi công thức phân tử của A là CxHy (x,y € N*)
Ta có tỉ lệ:
=> công thức tổng quát của A là: (CH3)n (n € N*)
Biết dA/H2 = 15 => MA = 15×MH2 = 15×2 = 30 (g/mol)
=> 15n = 30 => n = 2
Vậy, công thức phân tử của hidrocacbon A là C2H6 (etan)
c) Công thức cấu tạo của A: CH3-CH3
Chất A không làm mất màu dung dịch brom vì A chỉ có liên kết đơn trong phân tử
d) Phương trình hóa học:
C2H6 + Cl2 . C2H5Cl + HCl
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 11)
A. PHẦN TRẮC NGHIỆM: (3 điểm)
Khoanh tròn một trong các chữ cái A, B, C hoặc D trước kết quả đúng nhất
Câu 1 : Trong các hợp chất sau, hợp chất nào là hợp chất hữu cơ
A. (NH4)2CO3
B. NaHCO3
C. CO
D. C2H6O
Câu 2 : Thành phần chính của sợi bông gỗ nứa là
A. tinh bột
B. xenlulozơ
C. glucozơ
D. saccarozơ
Câu 3 : Iot tác dụng với chất nào sau đây tạo hợp chất màu xanh
A. tinh bột
B. xenlulozơ
C. glucozơ
D. saccarozơ
Câu 4 : Cồn trong y tế để xác trùng vết thương là
A. 960
B. 700
C. 450
D. 400
Câu 5 : Chất làm mất màu dung dịch brom là
A. C2H2
B. CH4
C. C2H5OH
D. CH3COOH
Câu 6 : Chất tác dụng được với axit axetic
A. Fe
B. Cu
C. Au
D. Ag
Câu 7 : Chất nào sau đây dùng để điều chế nhựa PE?
A. C2H2
B. CH4
C. C2H4
D. C6H6
Câu 8 : Hidrocacbon nào sau đây là chất lỏng ở điều kiện thường?
A. C2H2
B. CH4
C. C2H4
D. C6H6
Câu 9 : Cho các chất: K, NaOH, Cu, NaHCO3. Số chất tác dụng được với rượu etylic là
A. 1
B. 2
C. 3
D. 4
Câu 10 : Khối lượng benzen cần dùng để điều chế 15,7 gam brombenzen?
A. 15,6 g
B. 7,8 g
C. 7,75 g
D. 5,15 g
Câu 11 : Đốt cháy chất nào sau đây thu được số mol CO2 gấp đôi số mol H2O?
A. C2H2
B. CH4
C. C2H4
D. C6H6
Câu 12 : Biết 0,336 lít khí axetilen (đktc) làm mất màu tối đa V ml dung dịch brom 0,2M. Giá trị của V là?
A. 75
B. 150
C. 200
D. 300
B. PHẦN TỰ LUẬN
Bài 1 : Viết phương trình hóa học thực hiện chuỗi biến hóa sau (ghi điều kiện nếu có)
Bài 2 : Bằng phương pháp hóa học hãy nhận biết các chất sau: CH4,C2H4, CO2. Viết phương trình (nếu có)
Bài 3 : Cho 27,2 gam hỗn hợp A gồm ancol etylic và axit axetic tác dụng với natri dư thu được 5,6 lít khí H2 (đktc)
a) Viết phương trình hóa học của phản ứng
b) Tính khối lượng từng chất trong hỗn hợp A
c) Nếu hỗn hợp A trên làm thí nghiệm, thêm tiếp axit sunfuric đặc và đun nóng. Tính hiệu suất của phản ứng biết sau phản ứng thu được 14,08 gam etyl axetat.
Lời giải chi tiết
ĐÁP ÁN VÀ LỜI GIẢI CHI TIẾT
|
1.D |
2.B |
3.A |
4.B |
5.A |
6.A |
7.C |
8.D |
9.A |
10.B |
11.A |
12.B |
Câu 1:
Phương pháp:
Dựa vào định nghĩa về hợp chất hữu cơ: hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2,H2CO3 các muối cacbonat kim loại...)
Hướng dẫn giải:
C2H6O là hợp chất hữu cơ
Đáp án D
Câu 2:
Phương pháp:
Dựa vào trạng thái tự nhiên của các chất để chọn đáp án phù hợp
Hướng dẫn giải:
Thành phần chính của sợi bông gỗ nứa là xenlulozơ
Đáp án B
Câu 3:
Hướng dẫn giải:
Iot tạo hợp chất màu xanh tím với dung dịch hồ tinh bột
Đáp án A
Câu 4:
Phương pháp:
Dựa vào kiến thức hiểu biết thực tế về cồn y tế
Hướng dẫn giải:
Cồn trong y tế để xác trùng vết thương có nồng độ etylic từ 700 đến 750
Đáp án B
Câu 5:
Phương pháp:
Chất có nối đôi hoặc nối ba kém bền sẽ làm mất màu dung dịch nước brom
Hướng dẫn giải:
C2H2 có phản ứng với dd Br2 nên làm mất màu dung dịch Br2
Đáp án A
Câu 6:
Phương pháp:
Các kim loại đứng trước H trong dãy điện hóa thì có phản ứng với dung dịch CH3COOH
Hướng dẫn giải:
Chất tác dụng được với dd CH3COOH là Fe
2CH3COOH + Fe → (CH3COO)2Fe + H2↑
Đáp án A
Câu 7:
Hướng dẫn giải:
PE là polime etilen → được điều chế tử etilen C2H4
CH2=CH2 (-CH2-CH2-)n (PE)
Đáp án C
Câu 8:
Phương pháp:
Các hidroncacbon có từ 1 đến 4 cacbon ở thể khí, từ lớn hơn 4 cacbon trở lên ở thể lỏng hoặc rắn ở điều kiện thường.
Hướng dẫn giải:
C2H2, CH4,C2H2 đều là các hidrocacbon ở thể khí ở điều kiện thường
C6H6 là chất lỏng ở điều kiện thường
Đáp án D
Câu 9:
Phương pháp:
Dựa vào tính chất hóa học của C2H5OH
Hướng dẫn giải:
Có duy nhất K tác dụng được với rượu etylic → có 1 chất
2K + 2C2H5OH → 2C2H5OK + H2
Đáp án A
Câu 10:
Phương pháp:
Tính toán mol C6H6 theo mol C6H5Br dựa vào PTHH: C6H6 + Br2 . C6H5Br + HBr
Hướng dẫn giải:
PTHH: C6H6 + Br2 . C6H5Br + HBr
0,1 ← 0,1 (mol)
→ mC6H6 = 0,1.78 = 7,8 (g)
Đáp án B
Câu 11:
Phương pháp:
Giả sử đều đốt cháy 1 mol chất
Viết các phản ứng cháy của các chất ra, sau đó chọn chất có số mol CO2 gấp 2 lần mol H2O
Hướng dẫn giải:
Giả sử đều đốt cháy 1 mol chất
C2H2 + 2,5O2 2CO2 + H2O
CH4 + 2O2 CO2 + 2H2O
C2H4 + 3O2 2CO2 + 2H2O
C6H6 + 7,5O2 6CO2 + 3H2O
Vậy đốt C2H2 cho số mol CO2 gấp 2 lần mol H2O
Đáp án A
Câu 12:
Phương pháp:
Tính toán theo PTHH: C2H2 + 2Br2 → C2H2Br4
Hướng dẫn giải:
nC2H2(đktc) = 0,336 :22,4 = 0,015 (mol)
PTHH: C2H2 + 2Br2 → C2H2Br4
0,015 → 0,3 (mol)
nBr2 = 2nC2H2 = 2.0,015 = 0,03 (mol)
→ CM Br2 = nBr2 : V = 0,03 : 0,2 = 0,15 (lít) = 150 (ml)
Đáp án B
Câu 13:
Phương pháp:
Dựa vào phần tính chất hóa học về rượu etylic, axit axetic để hoàn thành phương trình hóa học.
Hướng dẫn giải:
Câu 14:
Phương pháp:
Dựa vào phần tính chất hóa học khác nhau của 3 khí để chọn thuốc thử nhận biết, chú ý tính chất hóa học khác biệt là chất này có mà chất kia không có và khi cho thuốc thử vào thì phải quan sát được hiện tượng rõ ràng như sự thay đổi về màu sắc dung dịch, có kết tủa hay không,...
Hướng dẫn giải:
Cho các khí lội qua dung dịch nước vôi trong dư, khí nào làm đục nước vôi trong thì đó là khí CO2, các khí còn lại không có hiện tượng là CH4 và C2H4
- Cho 2 khí còn lại này lội qua dung dịch nước Br2 dư, khí nào làm nhạt màu dung dịch nước Br2 thì đó là C2H4, khí còn lại không có hiện tượng gì là CH4
PTHH xảy ra:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
C2H4 + Br2 → C2H4Br2
(màu nâu đỏ) (dd không màu)
Câu 15:
Phương pháp:
a) ancol etylic + Na → muối + H2
axit axetic + Na → muối + H2
b) Đặt số mol C2H5OH và CH3COOH ban đầu lần lượt là x và y (mol)
Lập hệ hai phương trình với số mol H2 và khối lượng hỗn hợp A → x, y =?
c) acol etylic + axit axetic . este + H2O
xác định xem nếu H=100% thì ancol etylic hay axit axetic phản ứng hết. Từ đó tính toán hiệu suất phản ứng theo chất phản ứng hết.
Với lượng phản ứng thì tính theo số mol este thu được.
Hướng dẫn giải:
nH2(đktc) = 5,6/22,4 = 0,25 (mol)
a) PTHH xảy ra:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
x → 0,5x (mol)
2CH3COOH + 2Na → 2CH3COONa + H2
y → 0,5y (mol)
b) Đặt số mol C2H5OH và CH3COOH ban đầu lần lượt là x và y (mol)
Ta có hệ phương trình:
→ Khối lượng của C2H5OH là: 0,2× 46 = 9,2 (g)
→ Khối lượng của CH3COOH là: 0,3×60 = 18 (g)
c) số mol của CH3COOC2H5 thu được là:
PTHH: CH3COOH + C2H5OH . CH3COOC2H5 + H2O
Theo PT (mol): 1 : 1
Theo ĐB (mol): 0,2 : 0,3
Ta có: .
Do vậy nếu H= 100% thì C2H5OH phản ứng hết, vậy hiệu suất tính theo số mol của C2H5OH.
Theo PTHH (3): nC2H5OH pư = nCH3COOC2H5 = 0,16 (mol)
Hiệu suất của phản ứng trên là:
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 12)
Câu 1 :
1. Bằng phương pháp hóa học hãy loại bỏ khí axetilen có lẫn trong metan để thu được khí metan tinh khiết. Viết phương trình hóa học xảy ra.
2. Viết công thức cấu tạo (đầy đủ và thu gọn) của các chất có công thức phân tử sau: C3H8, C3H6 (mạch vòng).
Câu 2 : Có các chất sau: C2H5OH, CH3COOH, C6H6, (C15H31COO)3C3H5.
a) Chất nào tan được trong nước? Chất nào làm đổi màu quỳ tím hóa đỏ?
b) Chất nào tác dụng được với nhau khi đun nóng và có axit sunfuric đặc xúc tác?
c) Chất nào làm mất màu brom lỏng nguyên chất?
d) Chất nào có phản ứng thủy phân trong dung dịch axit?
Viết các phương trình hóa học xảy ra, ghi rõ điều kiện nếu có.
Câu 3 : Nêu hiện tượng và viết phương trình hóa học xảy ra khi:
1. Dẫn khí etilen qua dung dịch brom.
2. Cho mẩu canxi cacbua vào nước.
Câu 4 : Cho 240 gam dung dịch axit axetic tác dụng với lượng dư canxi cacbonat. Sau phản ứng thu được 5,6 lít khí cacbonic ở đktc.
a) Viết phương trình phản ứng xảy ra.
b) Tính nồng độ % dung dịch axit axetic đã dùng.
c) Tính thể tích rượu etylic 400 cần dùng để điều chế lượng axit axetic trên biết khối lượng riêng của rượu D = 0,8 g/ml.
Cho biết: C = 12; H = 1; O = 16; Ca = 40.
------HẾT------
Lời giải chi tiết
Câu 1:
Phương pháp:
1. Dựa vào tính chất hóa học khác nhau của axetilen và metan, đưa ra được chất mà khi cho vào hh khí chỉ có axetilen phản ứng, còn metan không phản ứng, từ đó ta sẽ thu được metan tinh khiết.
2. Dựa vào kiến thức học về cách viết công thức hóa học hữu cơ. Đảm bảo cacbon hóa trị IV, hidro hóa trị I
Hướng dẫn giải:
1. Dẫn hỗn hợp khí axetilen và metan qua dung dịch nước Br2 dư, khi đó khí axetilen sẽ bị giữ lại, còn khí metan không có phản ứng với dd Br2 sẽ thoát ra ngoài, từ đó ta thu được khí metan tinh khiết
PTHH: C2H2 + 2Br2 → C2H2Br4
2.
|
Công thức phân tử |
Công thức cấu tạo đầy đủ |
Công thức cấu tạo thu gọn |
|
C3H8
|
|
CH3-CH2-CH3 |
|
C3H6
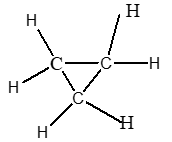
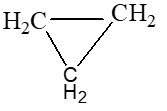
|
 |
 |
Câu 2:
Phương pháp:
Dựa vào tính chất vật lí và tính chất hóa học đã được học về các chất trên.
Hướng dẫn giải:
a) Các chất tan được trong nước là: C2H5OH, CH3COOH
Chất làm quỳ tím chuyển sang màu đỏ là: CH3COOH
b) Các chất tác dụng được với nhau khi đun nóng và có axit sunfuric đặc xúc tác là C2H5OH và CH3COOH
CH3COOH + C2H5OH CH3COOC2H5 + H2O
c) C6H6 tác dụng với Br2 lỏng nguyên chất khi có mặt xúc tác
C6H6 + Br2 C6H5Br + HBr
d) chất có phản ứng thủy phân trong môi trường axit là: (C15H31COO)3C3H5.
(C15H31COO)3C3H5 + 3H2O 3C15H31COOH + C3H5(OH)3
Câu 3:
Phương pháp:
Hiện tượng quan sát được là những gì có thể thấy rõ được bằng mắt thường như sự thay đổi về màu sắc, chất rắn tan hay không tan, có xuất hiện kết tủa hay không; có khí thoát ra hay không ....
Hướng dẫn giải:
1. Hiện tượng: dung dịch brom nhạt màu dần đến mất màu nâu, do axetilen phản ứng với dung dịch brom theo:
PTHH: C2H2 + 2Br2 → C2H2Br4
(màu nâu đỏ) (không màu)
2. Hiện tượng: canxicacbua tan, đồng thời xuất hiện nhiều bọt khí không màu thoát ra ngoài, phản ứng có tỏa nhiệt
PTHH: CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Câu 4:
Phương pháp:
a) Viết PTHH xảy ra: axit + muối → muối mới + axit mới (đk: tạo ra chất kết tủa hoặc bay hơi)
b) Dựa vào PTHH viết ở phần a, tính được mol axit axetic pư theo số mol CO2, từ đó tính được khối lượng của axit axetic.
áp dụng công thức: ta sẽ tìm ra được nồng độ của axit
c) Viết PTHH của rượu etylic phản ứng lên men giấm để tạo ra axit axetic.
Từ PTHH tính được mol rượu pư => khối lượng rượu
áp dụng công thức: mC2H5OH = VC2H5OH. DC2H5OH → VC2H5OH =?
Có độ rượu = 400 →
Hướng dẫn giải:
Số mol của khí cacbonic sinh ra là:
a) PTHH: 2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2↑ + H2O
b) Theo PTHH: nCH3COOH pư = nCO2 = 0,25 (mol)
→ Khối lượng của CH3COOH là: 0,25 × 60 = 15 (g)
→ Nồng độ phần trăm của dung dịch đã dùng là:
c) PTHH: C2H5OH + O2 CH3COOH + H2O
Theo PTHH: nC2H5OH = nCH3COOH = 0,25 (mol)
→ Khối lượng của C2H5OH là: mC2H5OH = 0,25× 46 = 11,5 (g)
→ Khối lượng nguyên chất của rượu là:
VC2H5OH = mC2H5OH: DC2H5OH = 11,5 : 0,8 = 14,375 (ml)
→ Thể tích dung dịch rượu 400 cần lấy để điều chế lượng axit trên là:
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 13)
A. PHẦN TRẮC NGHIỆM: (3 điểm) Khoanh tròn một trong các chữ cái A, B, C hoặc D trước kết quả đúng nhất
Câu 1 Trong các hợp chất sau, hợp chất nào là hợp chất hữu cơ
A. (NH4)2CO3 B. NaHCO3
C. CO D. C2H6O
Câu 2 Thành phần chính của sợi bông gỗ nứa là
A. tinh bột B. xenlulozơ
C. glucozơ D. saccarozơ
Câu 3 Iot tác dụng với chất nào sau đây tạo hợp chất màu xanh
A. tinh bột B. xenlulozơ
C. glucozơ D. saccarozơ
Câu 4 Cồn trong y tế để xác trùng vết thương là
A. 960 B. 700
C. 450 D. 400
Câu 5 Chất làm mất màu dung dịch brom là
A. C2H2 B. CH4
C. C2H5OH D. CH3COOH
Câu 6 Chất tác dụng được với axit axetic
A. Fe B. Cu
C. Au D. Ag
Câu 7 Chất nào sau đây dùng để điều chế nhựa PE?
A. C2H2 B. CH4
C. C2H4 D. C6H6
Câu 8 Hidrocacbon nào sau đây là chất lỏng ở điều kiện thường?
A. C2H2 B. CH4
C. C2H4 D. C6H6
Câu 9 Cho các chất: K, NaOH, Cu, NaHCO3. Số chất tác dụng được với rượu etylic là
A. 1 B. 2
C. 3 D. 4
Câu 10 Khối lượng benzen cần dùng để điều chế 15,7 gam brombenzen?
A. 15,6 g B. 7,8 g
C. 7,75 g D. 5,15 g
Câu 11 Đốt cháy chất nào sau đây thu được số mol CO2 gấp đôi số mol H2O?
A. C2H2 B. CH4
C. C2H4 D. C6H6
Câu 12 Biết 0,336 lít khí axetilen (đktc) làm mất màu tối đa V ml dung dịch brom 0,2M. Giá trị của V là?
A. 75 B. 150
C. 200 D. 300
B. PHẦN TỰ LUẬN
Bài 1 Viết phương trình hóa học thực hiện chuỗi biến hóa sau (ghi điều kiện nếu có)
Bài 2 Bằng phương pháp hóa học hãy nhận biết các chất sau: CH4,C2H4, CO2. Viết phương trình (nếu có)
Bài 3 Cho 27,2 gam hỗn hợp A gồm ancol etylic và axit axetic tác dụng với natri dư thu được 5,6 lít khí H2 (đktc)
a) Viết phương trình hóa học của phản ứng
b) Tính khối lượng từng chất trong hỗn hợp A
c) Nếu hỗn hợp A trên làm thí nghiệm, thêm tiếp axit sunfuric đặc và đun nóng. Tính hiệu suất của phản ứng biết sau phản ứng thu được 14,08 gam etyl axetat.
Lời giải chi tiết
ĐÁP ÁN
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1:
Phương pháp: Dựa vào định nghĩa về hợp chất hữu cơ: hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2,H2CO3 các muối cacbonat kim loại...)
Hướng dẫn giải: C2H6O là hợp chất hữu cơ
Đáp án D
Câu 2:
Phương pháp: Dựa vào trạng thái tự nhiên của các chất để chọn đáp án phù hợp
Hướng dẫn giải: Thành phần chính của sợi bông gỗ nứa là xenlulozơ
Đáp án B
Câu 3:
Hướng dẫn giải: Iot tạo hợp chất màu xanh tím với dung dịch hồ tin bột
Đáp án A
Câu 4:
Phương pháp: Dựa vào kiến thức hiểu biết thực tế về cồn y tế
Hướng dẫn giải: Cồn trong y tế để xác trùng vết thương có nồng độ etylic từ 700 đến 750
Đáp án B
Câu 5:
Phương pháp: Chất có nối đôi hoặc nối ba kém bền sẽ làm mất màu dung dịch nước brom
Hướng dẫn giải: C2H2 có phản ứng với dd Br2 nên làm mất màu dung dịch Br2
Đáp án A
Câu 6:
Phương pháp: Các kim loại đứng trước H trong dãy điện hóa thì có phản ứng với dung dịch CH3COOH
Hướng dẫn giải:
Chất tác dụng được với dd CH3COOH là Fe
2CH3COOH + Fe → (CH3COO)2Fe + H2↑
Đáp án A
Câu 7:
Hướng dẫn giải:
PE là polime etilen → được điều chế tử etilen C2H4
CH2=CH2 (-CH2-CH2-)n (PE)
Đáp án C
Câu 8:
Phương pháp: Các hidroncacbon có từ 1 đến 4 cacbon ở thể khí, từ lớn hơn 4 cacbon trở lên ở thể lỏng hoặc rắn ở điều kiện thường.
Hướng dẫn giải:
C2H2, CH4,C2H2 đều là các hidrocacbon ở thể khí ở điều kiện thường
C6H6 là chất lỏng ở điều kiện thường
Đáp án D
Câu 9:
Phương pháp: Dựa vào tính chất hóa học của C2H5OH
Hướng dẫn giải:
Có duy nhất K tác dụng được với rượu etylic → có 1 chất
2K + 2C2H5OH → 2C2H5OK + H2
Đáp án A
Câu 10:
Phương pháp: Tính toán mol C6H6 theo mol C6H5Br dựa vào PTHH:
C6H6 + Br2 C6H5Br + HBr
Hướng dẫn giải:
PTHH: C6H6 + Br2 C6H5Br + HBr
0,1 ← 0,1 (mol)
→ mC6H6 = 0,1.78 = 7,8 (g)
Đáp án B
Câu 11:
Phương pháp: Giả sử đều đốt cháy 1 mol chất
Viết các phản ứng cháy của các chất ra, sau đó chọn chất có số mol CO2 gấp 2 lần mol H2O
Hướng dẫn giải:
Giả sử đều đốt cháy 1 mol chất
C2H2 + 2,5O2 2CO2 + H2O
CH4 + 2O2 CO2 + 2H2O
C2H4 + 3O2 2CO2 + 2H2O
C6H6 + 7,5O2 6CO2 + 3H2O
Vậy đốt C2H2 cho số mol CO2 gấp 2 lần mol H2O
Đáp án A
Câu 12:
Phương pháp: Tính toán theo PTHH: C2H2 + 2Br2 → C2H2Br4
Hướng dẫn giải:
nC2H2(đktc) = 0,336 :22,4 = 0,015 (mol)
PTHH: C2H2 + 2Br2 → C2H2Br4
0,015 → 0,3 (mol)
nBr2 = 2nC2H2 = 2.0,015 = 0,03 (mol)
→ V = nBr2 : CM Br2 = 0,03 : 0,2 = 0,15 (lít) = 150 (ml)
Đáp án B
Câu 13:
Phương pháp: Dựa vào phần tính chất hóa học về rượu etylic, axit axetic để hoàn thành phương trình hóa học.
Hướng dẫn giải:
Câu 14:
Phương pháp:
Dựa vào phần tính chất hóa học khác nhau của 3 khí để chọn thuốc thử nhận biết, chú ý tính chất hóa học khác biệt là chất này có mà chất kia không có và khi cho thuốc thử vào thì phải quan sát được hiện tượng rõ ràng như sự thay đổi về màu sắc dung dịch, có kết tủa hay không,...
Hướng dẫn giải:
Cho các khí lội qua dung dịch nước vôi trong dư, khí nào làm đục nước vôi trong thì đó là khí CO2, các khí còn lại không có hiện tượng là CH4 và C2H4
- Cho 2 khí còn lại này lội qua dung dịch nước Br2 dư, khí nào làm nhạt màu dung dịch nước Br2 thì đó là C2H4, khí còn lại không có hiện tượng gì là CH4
PTHH xảy ra:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
C2H4 + Br2 → C2H4Br2
(màu nâu đỏ) (dd không màu)
Câu 15:
Phương pháp:
a) ancol etylic + Na → muối + H2
axit axetic + Na → muối + H2
b) Đặt số mol C2H5OH và CH3COOH ban đầu lần lượt là x và y (mol)
Lập hệ hai phương trình với số mol H2 và khối lượng hỗn hợp A → x, y =?
c) acol etylic + axit axetic este + H2O
xác định xem nếu H=100% thì ancol etylic hay axit axetic phản ứng hết. Từ đó tính toán hiệu suất phản ứng theo chất phản ứng hết.
Với lượng phản ứng thì tính theo số mol este thu được.
Hướng dẫn giải:
nH2(đktc) = 5,6/22,4 = 0,25 (mol)
a) PTHH xảy ra:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
x → 0,5x (mol)
2CH3COOH + 2Na → 2CH3COONa + H2
y → 0,5y (mol)
b) Đặt số mol C2H5OH và CH3COOH ban đầu lần lượt là x và y (mol)
Ta có hệ phương trình:
→ Khối lượng của C2H5OH là: 0,2× 46 = 9,2 (g)
→ Khối lượng của CH3COOH là: 0,3×60 = 18 (g)
c) số mol của CH3COOC2H5 thu được là:
PTHH:
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Theo PT (mol): 1 : 1
Theo ĐB (mol): 0,2 : 0,3
Ta có: .
Do vậy nếu H= 100% thì C2H5OH phản ứng hết, vậy hiệu suất tính theo số mol của C2H5OH.
Theo PTHH (3):
nC2H5OH pư = nCH3COOC2H5 = 0,16 (mol)
Hiệu suất của phản ứng trên là:
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 14)
I./TRẮC NGHIỆM (2,0 điểm)
Câu 1 1,12 lít khí Axetilen làm mất màu tối đa bao nhiêu lít Br2 1M:
A. 0,1 lít. B. 0,15 lít.
C. 0,3 lít. D. 0,6 lít.
Câu 2 Phản ứng đặc trưng của metan là:
A. Phản ứng thủy phân. B. Phản ứng thế.
C. Phản ứng cộng. D. Phản ứng cháy.
Câu 3 Nhóm các nguyên tố nào được sắp xếp đúng theo chiều tính phi kim tăng dần
A. O,F, N, P. B. F, O, N, P.
C. O, N, P, F. D. P, N, O,F.
Câu 4 Sau khi làm thí nghiệm, khí clo dư được loại bỏ bằng cách sục khí clo vào:
A. Dung dịch NaOH. B. Dung dịch NaCl.
C. Nước. D. Dung dịch HCl.
II./TỰ LUẬN (8,0 đ)
Câu 5 Thực hiện chuỗi phản ứng sau:
Etilen → Rượu etylic → axit axetic → etyl axetat → Natri axetat
Câu 6 Bằng phương pháp hóa học hãy nhận biết các chất khí riêng biệt sau: C2H4, SO2, Cl2.
Câu 7 Đốt cháy hoàn toàn một hidrocacbon A, mạch hở ở thể khí thu được 13,44 lít khí CO2 ở đktc, 10,8 g H2O. Xác định công thức phân tử của A, biết tỉ khối của A so với hidro bằng 28. Viết công thức cấu tạo của A?
Câu 8 Cho 19,4 gam hỗn hợp gồm Zn và Cu vào dd axit axetic có dư, sau phản ứng hoàn toàn thu được 4,48 lít khí không màu (đktc). Hãy tính khối lượng và phần trăm theo khối lượng mỗi chất trong hỗn hợp đầu.
Lời giải chi tiết
HƯỚNG DẪN GIẢI CHI TIẾT
I.TRẮC NGHIỆM (2,0đ)
Câu 1:
Phương pháp:
Tính toán theo PTHH: C2H2 + 2Br2 → C2H2Br4
Ghi nhớ công thức chuyển đổi: n(đktc) = V : 22,4
V = n : CM
Hướng dẫn giải:
nC2H2(đktc) = 1,12:22,4 = 0,05 (mol)
C2H2 + 2Br2 → C2H2Br4
0,05 → 0,1 (mol)
nBr2 = 2nC2H2 = 0,1 (mol)
=> VBr2 = n: CM = 0,1 : 1 = 0,1 (l)
Đáp án A
Câu 2:
Phương pháp:
Dựa vào kiến thức được học về metan trong sgk hóa 9
Hướng dẫn giải:
Metan là hidrocacbon no nên phản ứng đặc trưng là phản ứng thế (với Cl2, điều kiện ánh sáng)
Đáp án B
Câu 3:
Phương pháp:
Trong bảng hệ thống tuần hoàn, đi từ trái sang phải tính phi kim tăng dần, đi từ trên xuống dưới tính phi kim giảm dần
Hướng dẫn giải:
Trong cùng 1 nhóm đi từ trên xuống dưới tính phi kim giảm dần => P < N
Trong cùng 1 chu kì đi từ trái sang phải, tính phi kim tăng dần => N < O < F
=> thứ tự đúng: P < N < O < F
Đáp án D
Câu 4:
Phương pháp:
Chọn dd mà có phản ứng với Cl2 sinh ra chất không độc hại, từ đó sẽ loại bỏ được Cl2 thừa.
Hướng dẫn giải:
Clo được loại bỏ bằng cách cho sục vào dd NaOH vì có phản ứng
Cl2 + 2NaOH → NaCl + NaClO + H2O
Khi đó Cl2 sẽ bị giữ lại, tránh thoát ra ngoài gây độc hại môi trường
Đáp án A
II./TỰ LUẬN
Câu 5: (Mỗi phương trình đúng 0,5đ)
Phương pháp:
Dựa vào kĩ năng viết các phương trình hóa học xảy ra, hầu hết tất cả các phương trình đã được học trong sgk hóa 9
Hướng dẫn giải:
Câu 6:
Phương pháp:
Dựa vào tính chất hóa học khác nhau của các chất để chọn thuốc thử phù hợp
Lưu ý: hiện tượng quan sát được phải rõ ràng, các hiện tượng nhìn được bằng mắt thường (sự thay đổi màu sắc, xuất hiện kết tủa hay không, có khí thoát ra hay không)
Hướng dẫn giải:
Dùng quỳ tím ẩm cho lần lượt vào các khí
+ Qùy tím ẩm chuyển sang màu đỏ là khí SO2
+ Qùy tím ẩm mất màu là khí Cl2
+ quỳ tím ẩm không đổi màu là C2H2
SO2 + H2O H2SO3 (có môi trường axit nên làm quỳ chuyển đỏ)
Cl2 + H2O HCl + HClO (có tính oxi hóa mạnh nên làm quỳ tím mất màu)
Câu 7:
Phương pháp:
- Bước 1: đi tìm công thức đơn giản nhất của A
- Bước 2: Có phân tử khối của A từ đó tìm được công thức phân tử của A
- Bước 3: Viết các công thức cấu tạo thỏa mãn
Hướng dẫn giải:
Số mol CO2 (đktc) = 13,44 :22,4 = 0,6 (mol)
=> nC = 0,6 (mol)
Số mol H2O (đktc) = 10,08 :18 = 0,6 (mol)
=> nH = 2nH2O = 1,2 (mol)
nC : nH = 0,6 : 1,2 = 1:2
=> Công thức của A có dạng: (CH2)n
MA = 18.2 = 56 (g/mol)
=> 14.n = 56
=> n = 4
Vậy CTPT của A là: C4H8
4 CTCT của A là:
CH2=CH-CH2-CH2
CH3-CH=CH-CH3 (cis + trans)
CH2=C(CH3)-CH3
Câu 8:
Phương pháp:
Tính toán theo PTHH:
Zn + 2CH3COOH → (CH3COO)2Zn + H2
Hướng dẫn giải:
nH2(đktc) = 4,48 :22,4 = 0,2(mol)
PTHH: Zn + 2CH3COOH → (CH3COO)2Zn + H2
Theo PTHH: nZn = nH2 = 0,2 (mol)
=> mZn = 0,2.65 = 13 (g)
=> mCu = 19,4 - 13 = 6,4 (g)
Phần trăm khối lượng của các kim loại trong hỗn hợp là:
%Zn = (mZn: mhh).100% = (13 :19,4).100% = 67,01%
% Cu = 100% -% Zn = 100% - 67,01% = 32,99%
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 15)
I. TRẮC NGHIỆM: (2 điểm)
Hãy khoanh tròn một trong các chữ cái A,B C hoặc D ở các câu sau đây, nếu đúng.
Câu 1 Phát biểu không đúng là:
A. Clo là phi kim hoạt động hóa học mạnh hơn lưu huỳnh
B. Phản ứng giữa dung dịch NaOH với dung dịch NaHCO3 là phản ứng trung hòa.
C. Natri tiếp xúc với giấy lọc ẩm, giấy lọc bốc cháy, nhôm tiếp xúc giấy lọc không bốc cháy
D. Tất cả các muối cacbonat và muối hidrocacbonat đều bị phân hủy bởi nhiệt.
Câu 2 Chất tác dụng được với: Na, Na2O, NaOH, Na2CO3, NaHCO3 là
A. glucozơ. B. rượu etylic.
C. axit axetic. D. etyl axetat.
Câu 3 Cho các chất: metan, etilen, axetilen,benzen, rượu etylic, axit axetic. Số chất có liên kết đôi là
A. 1. B. 3.
C. 2. D. 4
Câu 4 Chất X thế được với Cl2 (ánh sáng). Chất Y thế được (bột sắt, nhiệt độ). X, Y lần lượt là
A. Benzen, etilen. B. Axetilen, etilen.
C. Axetilen, metan. D. Metan, benzen.
II. TỰ LUẬN
Câu 1 Viết phương trình hóa học theo dãy chuyển đổi hóa học sau (ghi rõ điều kiện phản ứng - nếu có):
Câu 2 Lên men hoàn toàn 690 ml rượu etylic 80 thành giấm. Tính khối lượng axit axetic có trong giấm. Biết khối lượng riêng của rượu etylic tinh khiết là 0,8 g/ml.
Câu 3
1. Đốt cháy hoàn toàn 68,4 gam một hỗn hợp chất hữu cơ thu được 2,4 mol CO2 và 2,2 mol H2O.
Lập công thức hóa học của hợp chất này, biết phân tử khối của hợp chất 342đvC
2. Từ tinh bột có thể sản xuất rượu etylic theo sơ đồ:
-(C6H10O5)-n → nC6H12O6 → 2nC2H5OH + 2nCO2
Muốn điều chế 920 kg rượu etylic, cần một khối lượng tinh bột là bao nhiêu. Biết hiệu suất của quá trình 50%.
Lời giải chi tiết
ĐÁP ÁN
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1:
Hướng dẫn giải:
A. đúng
B. đúng; NaOH + NaHCO3 → Na2CO3 + H2O
C. đúng, vì giấy lọc có nước, mà Na thì phản ứng mãnh liệt với nước, còn Al thì không phản ứng được với nước, do vậy giấy lọc khi tiếp xúc với Na thì cháy, còn tiếp xúc với Al thì không cháy
D. Sai vì các muối Li2CO3; Na2CO3, K2CO3 không bị nhiệt phân hủy
Đáp án D
Câu 2:
Phương pháp:
Dựa vào tính chất hóa học của các chất đã cho trong đáp án để loại trừ và lựa chọn được đáp án phù hợp
Hướng dẫn giải:
Chất tác dụng được với tất cả Na, Na2O, NaOH, Na2CO3, NaHCO3 là axit axetic (CH3COOH)
CH3COOH + Na → CH3COONa + 1/2H2↑
2CH3COOH + Na2O → 2CH3COONa + H2O
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2↑
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2↑
Đáp án C
Câu 3:
Phương pháp:
Dựa vào công thức cấu tạo của các chất đã được học
Hướng dẫn giải:
Công thức hóa học của metan ; etilen, axetilen,benzen, rượu etylic, axit axetic lần lượt của các chất
metan: CH4 chỉ toàn liên kết đơn
etilen: CH2 = CH2 => chứa 1 liên kết đôi
axetilen: CH≡CH => chứa 1 liên kết ba
benzen: 
rượu etylic: CH3-CH2-OH =>chỉ chứa liên kết đơn
axit axetic: 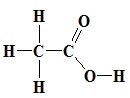
Vậy có 3 chất có liên kết đôi trong phân tử
Đáp án B
Câu 4:
Hướng dẫn giải:
Chất X là metan (CH4) ; chất Y là benzen (C6H6)
CH4 + Cl2 CH3Cl + HCl
C6H6 + Cl2 C6H5Cl + HCl
Đáp án D
II. TỰ LUẬN: (8,0đ)
Câu 1:
Phương pháp:
Viết các phương trình hóa học xảy ra, cân bằng phản ứng
Hướng dẫn giải:
(1) C2H4 + H2O C2H5OH
(2) C2H5OH + CH3COOH CH3COOC2H5 + H2O
(3) CH3COOC2H5 + NaOH CH3COONa + C2H5OH
(4) 2C2H5OH + 2Na → 2C2H5ONa + H2
Câu 2
Phương pháp:
Tính thể tích rượu theo cống thức
Từ đó tính được khối lượng rượu theo công thức: mr = Vr. dr
Sau đó tính được mol rượu: nr = mr : Mr
Viết PTHH xảy ra, sau đó tính toán khối lượng axit theo phương trình hóa học.
Hướng dẫn giải:
Thể tích rượu etylic tinh khiết: (690×8) :100 = 55,2 ml
Khối lượng rượu etylic tinh khiết: 55,2 × 0,8 = 44,16 g
Số mol rượu etylic tinh khiết: 44,16 : 46 = 0,96 mol
C2H5OH + O2 CH3COOH + H2O
0,96 0,96
Khối lượng axit axetic thu được: 0,96 × 60 = 57,6 g
Câu 3
Phương pháp:
1. Đặt công thức của hỗn hợp là: CxHyOz (x,y, z € N*)
Ta có: x : y : z = nC : nH : nO
Với nC = nCO2; nH = 2nH2O ; nO
tìm dựa vào khối lượng cho của hỗn hợp (có thể có hoặc không có oxi trong hợp chất)
biết phân tử khối của hợp chất 342đvC suy ra được công thức phân tử
2. Đổi số mol rượu, sau đó dựa vào sơ đồ tính được khối lượng lí thuyết tinh bột cần lấy
Vì %H = 50%
=> Khối lượng tinh bột thực tế cần lấy = mtb lí thuyết ×100% :%H =?
Hướng dẫn giải:
1.
nC = nCO2 = 2,4 (mol) => mC = 2,4×12 = 28,8 (g)
nH = 2nH2O = 2×2,2 = 4,4 (mol) => mH = 4,4×1 = 4,4 (g)
Ta thấy mC + mH = 28,8 + 4,4 = 33,2 (g) < 68,4 (g)
=> trong hỗn hợp có oxi
mO = mhh - (mC + mO) = 68,4 - 33,2 = 35,2 (g)
=> nO = 35,2 : 16 = 2,2 (mol)
Đặt công thức của hỗn hợp là: CxHyOz (x,y, z € N*)
Ta có: x : y : z = nC : nH : nO
= 2,4 : 4,4: 2,2
= 12:22 :11
Vậy công thức đơn giản nhất là: C12H22O11
Vì phân tử khối của hợp chất là 342 đvC
=> (C12H22O11)n = 342
=> (12.12 +1.22 + 16.11).n = 342
=> 342n = 342
=> n = 1
Vậy công thức phân tử của hợp chất hữu cơ là C12H22O11
2.
Số mol của C2H5OH là:
-(C6H10O5)-n → nC6H12O6 → 2nC2H5OH + 2nCO2
10/n ← 20 (kmol)
Theo sơ đồ: n(C6H10O5)n =
Khối lượng tinh bột cần dùng theo lí thuyết là:
mtinh bột lí thuyết = ntb. Mtb =
Vì hiệu suất phản ứng là 50% nên lượng tinh bột cần lấy thực tế là:
mtinh bột thực tế = mtinh bột lí thuyết ×100% :%H
= 1620 ×100% :50% = 3240 (kg)
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 16)
I. TRẮC NGHIỆM : (3,0 điểm)
Chọn phương án đúng trong mỗi câu sau:
Câu 1: Dãy các chất nào sau đây đều tác dụng với dung dịch axit axetic
A. Na, CuO, BaCl2, KOH
B. Mg, KNO3 ,Cu, KOH
C. Zn, NaOH, CaCO3, MgO.
D. Na2SO4, Ag, Cu(OH)2, MgCl2.
Câu 2: Trong các chất có công thức hóa học sau. Chất nào là Este của chất béo:
A. CH3COOC2H5.
B. CH3COONa.
C. C17H35COOH.
D. (C17H35COO)3C3H5.
Câu 3: Pha 4 lít rượu etylic 500 với 6 lít nước ta được
A. Rượu 50. B. Rượu 500
C. Rượu 100. D. Rượu 150
Câu 4: Chất nào sau đây vừa tham gia phản ứng thế, vừa tham gia phản ứng công:
A. Metan B. Benzen.
C. Etilen. D. Axetilen.
Câu 5: Cho m gam rượu etylic tác dụng hết với kim loại Na. Thể tích khí H2 thu được (đktc) 1,12 lít, thì khối lượng rượu etylic đã dùng là:
A. 10 g. B. 9,2 g.
C. 4,6 g. D. 2,3 g
Câu 6: Đốt cháy hoàn toàn một hidrocacbon X thu được 6,72 lít khí CO2 ở đktc và 5,4 g H2O. Công thức hóa học của X là:
A. C2H4. B. C2H2.
C. C2H6. D. C6H6
II. TỰ LUẬN : ( 7,0 điểm)
Câu 1: Trình bày tính chất hóa học của etylen? Viết các PTHH minh họa?
Câu 2: Bằng phương pháp hóa học, hãy nhận biết các chất lngr sau: Rượu etylic, nước cất, axit axetic đựng trong các lọ mất nhãn. Viết PTHH
Câu 3: Cho 9,2g rượu etylic tác dụng hết với Na
a. Tính thể tích khí H2 thu được ở đktc ?
b.Tính thể tích rượu etylic đã dùng ? Biết Dr = 0,8 g/ml
c. Tính thể tích không khí ( chứa 20% thể tích O2) cần để đốt cháy hết rượu trên ?
d. Nếu pha rượu trên với 34,5 ml nước thì thu được rượu bao nhiêu độ?
Lời giải chi tiết
Hướng dẫn giải chi tiết
I. Trắc nghiệm
Câu 1:
Phương pháp:
Ghi nhớ tính chất hóa học của CH3COOH
Hướng dẫn giải:
A. Loại BaCl2
B. Loại Cu vì Cu là kim loại đứng sau H nên không có phản ứng với axit
C. Đúng
D. Loại Ag vì Ag là kim loại đứng sau H nên không có phản ứng với axit
Đáp án C
Câu 2:
Este của chất béo là este tạo bởi các axit béo ( từ 12 Cacbon trở nên) với glixerol ( C3H5(OH)3)
=> este có dạng: (RCOO)3C3H5.
=> (C17H35COO)3C3H5 thỏa mãn
Đáp án D
Câu 3:
Phương pháp:
Công thức tính độ rượu:
Hướng dẫn giải:
Thể tích rượu C2H5OH có trong 4 lít rượu 500C là:
Sau khi pha thêm 6 lít nước vào
=> Vhh rượu = 4 + 6 = 10 (lít)
Đáp án B
Câu 4:
Hướng dẫn giải:
Chất vừa tham gia phản ứng thế, vừa tham gia phản ứng cộng là benzen
VD: Phản ứng thế:
C6H6 + Br2 C6H5Br + HBr
Phản ứng cộng
C6H6 + 3H2 → C6H12
C6H6 + 3Cl2 → C6H6Cl6
Đáp án B
Câu 5:
Phương pháp:
Đổi số mol H2
Viết PTHH xảy ra:
C2H5OH + Na → C2H5ONa + ½ H2↑
Tính số mol C2H5OH theo số mol của H2
Hướng dẫn giải:
nH2 = 1,12: 22,4 = 0,05 (mol)
PTHH: C2H5OH + Na → C2H5ONa + ½ H2↑
0,1 ← 0,05 (mol)
=> mC2H5OH = 0,1.46 = 4,6 (g)
Đáp án C
Câu 6:
Phương pháp:
Gọi công thức của hidrocacbon X là: CxHy
Đổi số mol nCO2 = VCO2: 22,4 = ? (mol)
=> nC = nCO2 = ? (mol)
Đổi số mol nH2O = mH2O: 18 = ? (mol)
=> nH = 2nH2O =?(mol)
=> x : y = nC : nH
=> Công thức đơn giản nhất của hidrocacbon, từ đó suy ra CTPT của H-C
Hướng dẫn giải:
Gọi công thức của hidrocacbon X là: CxHy
nCO2 = 6,72: 22,4 = 0,3 (mol)
=> nC = nCO2 = 0,3 (mol)
nH2O = 5,4: 18 = 0,3 (mol)
=> nH = 2nH2O = 2.0,3 =0, 6 (mol)
=> x : y = nC : nH
= 0,3 : 0,6
= 1: 2
=> Công thức đơn giản nhất của hidrocacbon là: (CH2)n
Khi n = 2 => CTPT là C2H4
=> thấy đáp án A thỏa mãn
Khi n = 6 => CTPT là C6H12
Đáp án A
II. Tự luận
Câu 1:
Phương pháp:
Kể tính chất hóa học của C2H4 sau đó viết PTHH minh họa xảy ra
+ phản ứng cộng
+ phản ứng trùng hợp
+ phản ứng cháy
Hướng dẫn giải:
Tính chất hóa học của C2H4
+ Phản ứng cộng: ( + H2, dd Br2)
C2H4 + Br2 → C2H4Br2
C2H4 + H2 C2H6
+ Phản ứng trùng hợp
nCH2=CH2 (-CH2-CH2-)n
+ phản ứng cháy
C2H4 + 3O2 2CO2 + 2H2O
Câu 2:
Phương pháp:
Dùng quỳ tím để nhận biết các chất trên
Hướng dẫn giải:
Phân biệt: C2H5OH, H2O, CH3COOH
Bước 1: Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thư stuwj tương ứng
Bước 2: Cho quỳ tím vào từng ống nghiệm trên
+ quỳ tím chuyển sang màu đỏ: CH3COOH
+ quỳ tím không chuyển màu là: C2H5OH và H2O
Bước 3: 2 chất còn lại là C2H5OH và H2O ta đem đốt
+ Chất nào cháy là C2H5OH
C2H5OH + 3O2 2CO2 + 3H2O
+ Chất còn lại không cháy là H2O
Câu 3:
Phương pháp:
Đổi số mol của nC2H5OH = mC2H5OH : 46 = ? (mol)
a) Viết PTHH xảy ra:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Tính theo PTHH số mol của H2 theo số mol của C2H5OH đã biết
b) Ghi nhớ công thức chuyển đổi giữa các đại lượng:
c) Viết PTHH xảy ra: C2H5OH + 3O2 2CO2 + 3H2O
Tính theo PTHH: nO2 = 3nC2H5OH = ? (mol)
=> VO2 (đktc) = nO2 . 22,4 = ? (lít)
Vì O2 chiếm 20% thể tích không khí
=>
d) Thể tích hỗn hợp sau khi pha là:
Vhh = Vr + Vnước = ? (ml)
Hướng dẫn giải:
nC2H5OH = 9,2 : 46 = 0,2 (mol)
a) PTHH: 2C2H5OH + 2Na → 2C2H5ONa + H2↑
Theo PTHH: nH2 = ½ nC2H5OH = ½. 0,2 = 0,1 (mol)
=> VH2 (đktc) = 0,1.22,4 = 2,24 (lít)
b)
1 ml C2H5OH có mr = Dr. Vr = 0,8× 1= 0,8 (g)
x (ml) C2H5OH có mr = 9,2 (g)
=>
c) PTHH: C2H5OH + 3O2 2CO2 + 3H2O
Theo PTHH: nO2 = 3nC2H5OH = 3. 0,2 = 0,6 (mol)
=> VO2 (đktc) = 0,6. 22,4 = 13,44 (lít)
Vì O2 chiếm 20% thể tích không khí =>
d)
Thể tích hỗn hợp sau khi pha là:
Vhh = Vr + Vnước = 11,5 + 34,5= 46 (ml)
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 17)
I. TRẮC NGHIỆM : ( 3 điểm) Chọn ý trả lời đúng nhất trong các ý sau:
Câu 1: Dãy chất gồm hiđrocacbon
A. C6H12O6, C6H6, C5H10
B. C2H4, C3H6, CH3Cl
C. C2H2, CH4, C2H6O.
D. C2H4, CH4, C6H6.
Câu 2: Để thu được CH4 tinh khiết từ hỗn hợp CH4 và CO2, ta dẫn hỗn hợp khí qua
A. dung dịch H2SO4 đặc dư.
B. dung dịch Ca(OH)2 dư.
C. dung dịch nước brom dư.
D. dung dịch muối ăn dư.
Câu 3: Chất vừa tham gia phản ứng thế, vừa tham gia phản ứng cộng
A. CH4. B. C2H4.
C. C2H2. D. C6H6.
Câu 4: Công thức hóa học viết sai
A. CH2=CH-CH3. B. CH3-CH3
C. CH2-CH2. D. CH2=CH2.
Câu 5: Dãy chất đều tham gia phản ứng thủy phân
A. chất béo, saccarozơ, tinh bột
B. tinh bột, xenlulozơ, glucozơ.
C. tinh bột, glucozơ, protein.
D. glucozơ, saccarozơ, xenlulozơ.
Câu 6: Trên vỏ lon bia Tiger 330 ml có ghi độ cồn ( độ rượu) là 4,60. Vậy thể tích rượu etylic có trong 330 ml bia trên là
A. 14,12 ml. B. 15,18 ml
C. 13,18ml. D. 11,35 ml.
Câu 7: Đốt cháy hợp chất hữu cơ X trong khí oxi, sản phẩm thu được gồm: CO2, H2O và N2. Vậy X là:
A. tinh bột. B. glucozơ.
C. xenlulozơ. D. protein.
Câu 8: Một hợp chất A là chất lỏng không màu, tan vô hạn trong nước, tác dụng với natri giải phóng khí H2. A tham gia phản ứng este hóa nhưng không tác dụng với Na2CO3.
A. C2H5OH. B. CH3-O-CH3.
C. CH3COOH. D. CH3COOC2H5.
Câu 9: Có sơ đồ phản ứng sau: .
Các chất A, B, C lần lượt là
A. axit axetic, rượu etylic, etyl axetat.
B. etyl axetat, rượu etylic, axit axetic.
C. rượu etylic, axit axetic, etyl axetat
D. axetilen, rượu etylic, etyl axetat.
Câu 10: Khi thủy phân chất béo trong môi trường axit ta thu được
A. glixerol và axit béo.
B. glixerol và muối của axit béo.
C. glixerol và hỗn hợp muối của axit béo.
D. glixerol và hỗn hợp các axit béo.
Câu 11: Dãy muối cacbonat bị thủy phân ở nhiệt độ cao
A. Na2CO3, Ca(HCO3)2.
B. K2CO3, KHCO3.
C. CaCO3, Ca(HCO3)2.
D. MgCO3, K2CO3.
Câu 12: Trong một chu kì, khi đi từ đầu đến cuối chu kì theo chiều tăng dần của điện tích hạt nhân
A. tính phi kim của các nguyên tố giảm dần.
B. tính kim loại của các nguyên tố tăng lên.
C. tính chất các nguyên tố không thay đổi.
D. tính kim loại của các nguyên tố giảm dần.
II. TỰ LUẬN
Câu 1: Viết phương trình hóa học thực hiện chuỗi phản ứng sau, ghi rõ điều kiện ( nếu có):
Câu 2: Bằng phương pháp hóa học, hãy nhận biết các chất lỏng không màu đựng trong các lọ riêng biệt mất nhãn sau: dung dịch glucozơ, axit axetic, rượu etylic.(Viết phương trình hóa học xảy ra nếu có).
Câu 3: Nêu hiện tượng và viết phương trình hóa học của phản ứng (nếu có) khi:
a. Cho dung dịch CH3COOH vào ống nghiệm có chứa dung dịch Na2CO3.
b. Cho dung dịch CH3COOH vào ống nghiệm có chứa một ít kim loại đồng.
Câu 4: Đốt cháy hoàn toàn 23 gam hợp chất hữu cơ X chứa C, H, O thu được 44 gam CO2, 27 gam H2O. Xác định công thức phân tử của X, biết khối lượng mol phân tử của X là 46 gam/mol.
Câu 5: Thực hiện phản ứng este hóa hoàn toàn 28,75 ml rượu etylic 800 với axit axetic.
a. Tính khối lượng etyl axetat thu được, biết hiệu suất của phản ứng este hóa là 75%
b. Để có được lượng rượu etylic thực hiện phản ứng trên, người ta đã lên men rượu bao nhiêu gam glucozơ?
Biết hiệu suất của phản ứng lên men rượu là 80%.
Lời giải chi tiết
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1:
Ghi nhớ: Hidrocacbon chỉ chứa nguyên tố C và H trong phân tử
Đáp án D
Câu 2:
Phương pháp:
Để thu được CH4 từ hỗn hợp CH4 và CO2 ta phải chọn thuốc thử nào phản ứng với CO2 nhưng không phản ứng với CH4.
Hướng dẫn giải:
Ca(OH)2 phản ứng với CO2, nhưng không phản ứng với CH4 => CH4 thoát ra ngoài, ta thu CH4 sẽ được tinh khiết.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Đáp án B
Câu 3:
Hướng dẫn giải:
C6H6 vừa tham gia phản ứng thế, vừa tham gia phản ứng cộng.
+ Phản ứng thế:
C6H6 + Br2 C6H5Br + HBr
+ phản ứng cộng
C6H6 + 3H2 C6H12
Đáp án D
Câu 4:
Hướng dẫn giải:
CH2-CH2 => viết sai vì C không đủ hóa trị IV trong hợp chất này.
Đáp án C
Câu 5:
Hướng dẫn giải:
Glucozo là chất không tham gia phản ứng thủy phân => loại B, C,D
Đáp án A
Câu 6:
Hướng dẫn giải:
Công thức tính độ rượu:
Đáp án B
Câu 7:
Hướng dẫn giải:
Từ sản phẩm thu được là CO2, H2O và N2 => ta suy ra chất ban đầu chắc chắn phải có nguyên tố C, H, N có thể có nguyên tố O
=> loại tinh bột, glucozo và xenlulozo vì không chứa N trong phân tử
=> chọn protein
Đáp án D
Câu 8:
Hướng dẫn giải:
chất A là chất lỏng không màu, tan vô hạn trong nước, tác dụng với natri giải phóng khí H2. A tham gia phản ứng este hóa => A có thể là C2H5OH hoặc CH3COOH
A không tác dụng với Na2CO3 => loại CH3COOH
Đáp án A
Câu 9:
Hướng dẫn giải:
CH2=CH2 + H2O C2H5OH
C2H5OH + O2 CH3COOH + H2O
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Đáp án C
Câu 10:
Hướng dẫn giải:
Chất béo có dang: (RCOO)3C3H5 bị thủy phân trong môi trường axit có phản ứng:
(RCOO)3C3H5 + 3H2O 3RCOOH + C3H5(OH)3 => thu được glixerol và hỗn hợp các axit béo
Đáp án D
Câu 11:
Hướng dẫn giải:
Ghi nhớ: Na2CO3 và K2CO3 không bị nhiệt phân hủy
=> loại A, B, D => chọn C
CaCO3 CaO + CO2↑
Ca(HCO3)2 CaCO3 + CO2 + H2O
Đáp án C
Câu 12:
Hướng dẫn giải:
Khi đi từ đầu đến cuối chu kì theo chiều tăng dần của điện tích hạt nhân số lớp e như nhau, điện tích hạt nhân tăng dần => khả năng hút e của hạt nhân tăng mạnh hơn => tính kim loại giảm dần, tính phi kim tăng dần do điện tích hạt nhân tăng.
Đáp án D
II. TỰ LUẬN
Câu 13:
Hướng dẫn giải:
Câu 14:
Phương pháp:
Sử dụng quỳ tím và kim loại Na để phân biệt 3 chất.
Hướng dẫn giải:
Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng:
- Cho quỳ tím lầ lượt vào từng ống nghiệm:
+ Qùy tím chuyển sang màu đỏ là: axit axetic
+ Qùy tím không chuyển màu là: dd glucozo và rượu etylic. ( dãy I)
- Cho mẩu Na lần lượt vào các ống nghiệm ở dãy (I)
+ ống nào thấy có sủi bọt khí thoát ra là: rượu etylic
2C2H5OH + 2Na → 2C2H5ONa + H2↑
+ ống nào không có hiện tượng gì là: dd glucozo
Câu 15:
Phương pháp:
Hiện tượng quan sát được: có khí thoát ra hay không, có kết tủa hay không? Dung dịch thu được có màu gì?
=> quan sát được gì, nêu hiện tượng đó.
Hướng dẫn giải:
a. Hiện tượng: có bọt khí thoát ra ngoài
2CH3COOH + Na2CO3 → 2CH3COONa + CO2↑ + H2O
b. Hiện tượng: bột đồng tan dần đến hết, dd thu được có màu xanh lam
2CH3COOH + Cu (đỏ) → (CH3COO)2Cu ( màu xanh lam) + H2O
Câu 16:
Phương pháp:
Tính nCO2 => nC = nCO2 => mC = ?
Tính nH2O => mH = 2nH2O => mH = ?
Khối lượng O trong X:
mO = 2,3 – mC – mH = ? => nO = ?
Gọi công thức của X có dạng: CxHyOz (x, y, z € N*)
Ta có: x : y : z = nC : nH : nO
=> Công thức đơn giản nhất
Có PTK của X = 46 => CTPT của X =?
Hướng dẫn giải:
Khối lượng O trong X là:
mO = 23 – mC – mH = 23 – 12 -3 = 8(g)
Gọi công thức của X có dạng: CxHyOz (x, y, z € N*)
Ta có: x : y : z = nC : nH : nO
= 1 : 3 : 0,5
= 2: 6 : 1
=> công thức đơn giản nhất của X là: (C2H6O)n
Vì phân tử khối của X = 46 (g/mol)
=> ( 12.2 + 6 + 16)n = 46
=> 46n = 46
=> n = 1
=> CTPT của X là C2H6O.
Câu 17:
Phương pháp:
Dr = 0,8 (g/ml) => m rượu = Vrượu . Dr = ?
PTHH: C2H5OH + CH3COOH CH3COOC2H5 + H2O
Tính được khối lượng este lí thuyết thu được theo phương trình:
Vì H = 75% nên lượng este thực tế thu được là:
b. PTHH: C6H12O6 2C2H5OH + 2CO2
Tính được khối lượng glucozo cần lấy theo lí thuyết ( theo phương trình)
Vì H = 80% nên lượng glucozo thực tế cần phải lấy là:
Hướng dẫn giải:
Dr = 0,8 (g/ml)
=> m rượu = Vrượu . Dr = 23. 0,8 = 18,4 (g)
PTHH:
C2H5OH + CH3COOH CH3COOC2H5 + H2O
Theo PTHH: nCH3COOOH = nC2H5OH = 0,4 (mol)
Khối lượng lí thuyết este thu được là:
mCH3COOH LT = 0,4. 88 = 35,2 (g)
Vì H = 75% nên lượng este thực tế thu được là:
b. C6H12O6 2C2H5OH + 2CO2
Theo PTHH:
nC6H12O6 = ½ nC2H5OH = ½. 0,4 = 0,2 (mol)
Khối lượng glucozo cần lấy theo lí thuyết là:
mC6H12O6 LT = 0,2. 180 = 36 (g)
Vì H = 80% nên lượng glucozo thực tế cần phải lấy là:
= 45g
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 18)
I.Trắc nghiệm khách quan ( mỗi câu 0,5 điểm)
Câu 1: Dãy các chất tác dụng được với dung dịch H2SO4 loãng là:
Câu 2: Đốt cháy hoàn toàn một lượng sắt trong khí clo dư. Hòa tan sản phẩm phản ứng vào nước thu được dung dịch X. Thêm dung dịch NaOH vào dung dịch X. Hiện tượng quan sát được sẽ là
A.chỉ tạo thành dung dịch không màu.
B.có chất kết tủa màu xanh tạo thành.
C.có chất kết tủa màu đỏ tạo thành.
D.có dung dịch màu nâu đó tạo thành.
Câu 3: Dãy gồm tất cả các chất không làm mất màu dung dịch brom là:
Câu 4: Điều nào sau đây không đúng?
A.Dầu thực vật và mỡ động vật là những chất béo.
B.Chất béo là hỗn hợp nhiều este.
C.Chất béo là hỗn hợp các este của glixerol với axit hữu cơ mà phân tử có nhiều nguyên tử cacbon.
D.Các chất béo đều bị thủy phân trong môi trường axit.
Câu 5: Cặp chất cùng tồn tại trong dung dịch là:
A.CH3COOH và H2SO4 loãng.
B.NaKCO3 và HCl
C.KNO3 và Na2CO3
D.NaHCO3 và NaOH.
Câu 6: Các chất được dùng điều chế trực tiếp etyl axetat là:
A.axit axetic, natri hidroxit, tinh bột.
B.axit axetic, rượu etylic, axit clohidric.
C.rượu etylic, nước và axit sunfuric đặc.
D.rượu etylic, axit axetic và axit sunfuric đặc.
Câu 7: Hãy chọn câu đúng:
A.Rượu etylic tan nhiều trong nước vì phân tử rượu etylic chỉ có liên kết đơn.
B.Những chất mà phân tử có nhóm – OH hoặc – COOH thì tác dụng được với NaOH.
C.Trong 1 lít rượu etylic 150 có 0,15 lít rượu etylic và 0,85 lít nước.
D.Natri có khả năng đẩy được tất cả các nguyên tử H ra khỏi phân tử rượu etylic.
Câu 8: Dung dịch ZnCl2 có tạp chất CuCl2 có thể dùng chất nào trong các chất sau đây để loại tạp chất trên?
A.Mg B.Zn
C.Cu D.Ni.
II.Tự luận (6 điểm)
Câu 9: (2 điểm) Có 2 dung dịch sau đựng riêng biệt 2 bình không dán nhãn:
Axit axetic và glucozo.
Hãy nêu 2 phương pháp hóa học để phân biệt mỗi dung dịch (dụng cụ, hóa chất coi như có đủ). Viết các phương trình hóa học (nếu có)
Câu 10 (2 điểm): Viết công thức cấu tạo thu gọn và viết phương trình hóa học với dung dịch H2SO4 và với dung dịch NaOH của một chất có công thức (C17H35COO)3C3H5.
Câu 11 ( 2 điểm): Cho 100ml etanol 960.
a)Tìm thể tích etanol nguyên chất.
b)Tính thể tích khí H2 (ở đktc) thu được khí đem 10ml rượu đó tác dụng với Na (dư).
(biết
Lời giải chi tiết
1.Đáp án
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
D |
C |
A |
B |
C |
D |
C |
B |
2.Lời giải
I.Trắc nghiệm khách quan (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (A)
Câu 2: (C)
2Fe + 3Cl2 2FeCl3 (t0)
FeCl3 + 3NaOH Fe(OH)3 (kết tủa màu nâu đỏ) + 3NaCl
Câu 3: (A)
CH4, C6H6, CH3COONa đều không tác dụng với dung dịch brom.
Câu 4: (B)
Chất béo là hỗn hợp nhiều este: sai.
Câu 5: (C)
KNO3 không tác dụng với nhau.
Câu 6: (D)
CH3COOH + C2H5OH CH3COOC2H5 + H2O (H2SO4 đặc, t0)
Câu 7: (C)
Trong 1 lít rượu etylic 150 có 0,15 lít rượu etylic và 0,85 lít nước.
Câu 8: (B)
Zn + CuCl2 ZnCl2 + Cu.
II.Tự luận (6 điểm)
Câu 9:
(1)Dùng quỳ tím: dung dịch làm đỏ quỳ tím là axit axetic.
(2) Dùng AgNO3 trong NH3: dung dịch cho Ag là glucozo.
Phương trình hóa học: C6H12O6 + Ag2O C6H12O7 + 2Ag (NH3)
(Cách tiến hành 0,5 điểm, (1) 0,5 điểm, (2) 1 điểm)
Câu 10:
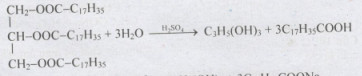
(C17H35COO)3C3H5 + 3NaOH C3H5(OH)3 + 3C17H35COONa
Viết công thức cấu tạo thu gọn: (1 điểm)
Viết phản ứng với dung dịch H2SO4 và với dung dịch NaOH: (1 điểm)
Câu 11:
Cho 100ml etanol 960
a) Thể tích rượu nguyên chất = 100.0,96 = 96ml
b) Thể tích khí H2 (ở đktc):
(Phương trình: 0,5 điểm. Tính : 0,5 điểm. Tính : 0,75 điểm)
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 19)
I.Trắc nghiệm khách quan (mỗi câu 0,5 điểm)
Câu 1: Dung dịch HCl có thể tác dụng với?
A.NaHCO3 B.KCl
C.CuSO4 D.AgBr
Câu 2: Oxit cacbon (CO) phản ứng với tất cả các chất trong dãy nào dưới đây?
Câu 3: Đốt cháy hoàn toàn chất hữu cơ X thu được CO2 và H2O với số mol bằng nhau. X là ?
A.C2H5OH B.C2H4
C.C2H2 D.C6H6.
Câu 4: Mọi chất hữu cơ đều
A.có mặt nguyên tố cacbon
B.chứa nguyên tố oxi.
C.có cùng công thức phân tử khi có cùng khối lượng mol.
D.chứa nguyên tố cacbon và nguyên tố hidro.
Câu 5: Benzen không phản ứng với
A.Br2 khan có bột Fe làm xúc tác.
B.không khí khi đốt.
C.H2 có mặt Ni nung nóng.
D.dung dịch Br2.
Câu 6: Dãy các chất phản ứng với kim loại kali là:
A.axit axetic, xenlulozo, polietilen.
B.tinh bột, rượu etylic, poli (vinyl clorua)
C.axit axetic, nước, rượu etylic.
D.axit axetic, xenlulozo, tinh bột.
Câu 7: Dãy nào sau đây gồm các chất bị thủy phân trong môi trường axit?
A.xenlulozo, polietilen, axit axetic.
B.Etyl axetat, rượu etylic, poli (vinyl clorua)
C.Glucozo, rượu etylic, fructozo.
D.Tinh bột, saccarozo, xenlulozo.
Câu 8: Nung hỗn hợp: C2H5OH, H2SO4 đặc ở 1700C thu được hỗn hợp khí gồm C2H4, CO2, SO2. Hóa chất nào sau đây được dùng để thu được khí C2H4 không lẫn khí CO2, SO2?
A.Dung dịch KMnO4
B.Dung dịch Br2
C.Dung dịch KOH
D.Dung dịch K2CO3.
II.Tự luận (6 điểm)
Câu 9: (2 điểm) Viết phương trình hóa học thể hiện chuyển hóa sau:
Câu 10 (2 điểm): Có 3 khí sau đựng riêng biệt trong 3 lọ: C2H4, Cl2, CH4.
Nêu phương pháp hóa học để nhận biết mỗi khí trong lọ (dụng cụ, hóa chất coi như có đủ)
Câu 11 (2 điểm): Để điều chế axit axetic người ta có thể lên men 1,5 lít rượu etylic 100
a)Thể tích rượu etylic nguyên chất đã dùng (biết
b)Tính khối lượng axit axetic tạo thành (biết hiệu suất phản ứng 80%, C = 12, H = 1, O = 16).
Lời giải chi tiết
1.Đáp án
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
A |
C |
B |
A |
D |
C |
D |
C |
2.Lời giải
I.Trắc nghiệm khách quan (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (A)
HCl + NaHCO3 NaCl + CO2 + H2O
Câu 2: (C)
CO không phản ứng với các oxit của kim loại hoạt động mạnh hay với kim loại.
Câu 3: (B)
Chỉ có C2H4 là thỏa mãn.
Câu 4: (A)
Mọi chất hữu cơ đều có mặt nguyên tố cacbon.
Câu 5: (D)
Benzen không phản ứng với dung dịch Br2.
Câu 6: (C)
Axit axetic, nước, rượu etylic đều phản ứng với kim loại K.
Câu 7: (D)
Tinh bột, saccarozo, xenlulozo, bị thủy phân trong môi trường axit.
Câu 8: (C)
Dung dịch KOH hấp thụ khí CO2, SO2 do tạo các muối KHCO3, KHSO4,…
II.Tự luận (6 điểm)
Câu 9:
Viết phương trình hóa học thể hiện những chuyển hóa sau:
(Mỗi phương trình 0,5 điểm)
Câu 10:
Trích mẫu lần lượt thử với các chất có màu ẩm, khí làm phai màu clo.
Hai khí còn lại thử với dung dịch brom, khi làm phai màu brom là C2H4.
Khí còn lại là CH4.
(Cách thực hiện 0,5 điểm. Nhận ra mỗi chất 0,5 điểm)
Câu 11:
a) Thể tích rượu etylic nguyên chất là:
b) Tính khối lượng axit axetic:
C2H5OH + O2 CH3COOH + H2O
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(Đề 20)
Câu 1: Nếu biết nguyên tố R tạo được với clo hợp chất có công thức hóa học RCl5. Công thức oxit cao nhất của R sẽ là:
A.R2O3 B.R2O5
C.RO3 D.R2O7.
Câu 2: Trong dãy các chất sau, dãy nào chỉ chứa chất hữu cơ?
Câu 3: Dãy gồm các chất đều làm mất màu dung dịch brom là:
Câu 4: Đốt nóng hỗn hợp bột CuO và C rồi dẫn khí thu được vào bình đựng nước vôi trong (dư). Hiện tượng quan sát được ở bình đựng nước vôi là:
A.nước vôi trong vẩn đục.
B.có chất rắn màu đỏ.
C,có hơi nước tạo thành còn màu chất rắn không thay đổi.
D.có chất rắn mầu đỏ tạo thành và nước vôi trong vẩn đục.
Câu 5: Thuốc thử nào sau đây được dùng để nhận ra rượu etylic và axit axetic?
A.Na B.NaHCO3
C.NaCl D.KCl
Câu 6: Dãy các chất không bị thủy phân trong môi trường axit là:
A.polietilen, rượu etylic, poli (vinyl clorua)
B.tinh bột, protein, saccarozo.
C.xenlulozo, saccarozo, glucozo.
D.tinh bột, xenlulozo, protein.
Câu 7: Để nhận biết các lọ mất nhãn riêng biệt chứa các chất CO2, CH4, C2H4 ta dùng các thuốc thử
A.dung dịch phenolphtalein.
B.giấy đo độ pH
C.nước vôi trong và dung dịch brom
D.nước và giấy quỳ tím.
Câu 8: Dẫn 1,12 lít khí C2H4 (đktc) vào 200ml dung dịch Br2 1M.
Màu da cam của dung dịch brom sẽ:
A.nhạt dần
B.chuyển thành không màu
C.chuyển thành vàng đậm hơn.
D.không thay đổi gì.
II.Tự luận (6 điểm)
Câu 9 (2 điểm): Hoàn thành các phương trình hóa học sau:
Câu 10 (2 điểm): Đốt cháy hoàn toàn 6 gam chất hữu cơ A. Thu được 8,8 gam khí CO2 và 3,6 gam H2O.
a)Trong chất hữu cơ A có những nguyên tố nào?
b)Biết phân tử khối của A trong khoảng từ 55 đvC đến 65 đvC.
Tìm công thức phân tử của A (cho C = 12, O = 16, H = 1)
Câu 11 (2 điểm): Có hỗn hợp A gồm rượu etylic và axit axetic. Cho 21,2 gam A phản ứng với Na (dư) thì thu được 4,48 lít khí (đktc).
Tính phần trăm khối lượng mỗi chất trong hỗn hợp A (cho C = 12, O = 16, H = 1)
Lời giải chi tiết
1.Đáp án
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
D |
B |
A |
B |
A |
C |
A |
2.Lời giải
I.Trắc nghiệm khách quan (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (B)
Xem bảng tuần hoàn các nguyên toán hóa học.
Câu 2: (D)
CO2, Na2CO3, CO không phải là các hợp chất hữu cơ.
Câu 3: (B)
Dãy các chất đều làm mất màu dung dịch brom.
Câu 4: (A)
Câu 5: (B)
Câu 6: (A)
Polietilen, rượu etylic, poli (vinyl clorua) không bị thủy phân trong môi trường axit.
Câu 7: (C)
Nước vôi trong nhận biết CO2, dung dịch brom nhận biết C2H4, còn lại là CH4.
Câu 8: (A)
nên Br2 còn, dung dịch chỉ nhạt màu.
II.Tự luận (6 điểm)
Câu 9:
Hoàn thành các phương trình hóa học sau:
(mỗi phương trình 0,5 điểm)
Câu 10:
a)Trong chất hữu cơ A có những nguyên tố: C, H, O
Công thức đơn giản nhất: CH2O
Công thức phân tử: (CH2O)n
CTPT là C2H4O2
Câu 11:
Gọi x, y lần lượt là số mol của CH3COOH và C2H5OH trong hỗn hợp A.
và
Giải ra ta có:
Khối lượng CH3COOH là gam.
Phần trăm khối lượng CH3COOH