Tailieumoi.vn xin giới thiệu phương trình FeS + 2HCl → FeCl2 + H2S↑ gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Sắt. Mời các bạn đón xem:
Phương trình FeS + 2HCl → FeCl2 + H2S↑
1. Phương trình phản ứng hóa học
FeS + 2HCl → FeCl2 + H2S↑
2. Hiện tượng của phản ứng
- FeS tan dần, thoát ra khí không màu, mùi trứng thối.
3. Điều kiện của phản ứng
- Phản ứng diễn ra ở ngay điều kiện thường.
4. Tính chất hoá học
4.1. Tính chất hoá học của FeS
- Có tính chất hóa học của muối.
- Tác dụng với axit:
FeS + 2HCl → FeCl2 + H2S
4.2. Tính chất hóa học của HCl
Axit clohiđric là một axit mạnh, mang đầy đủ tính chất hóa học của một axit như:
- Làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại.
Ví dụ:
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Kim loại có nhiều hóa trị tác dụng với dung dịch HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
Fe + 2HCl → FeCl2 + H2
- Tác dụng với oxit bazơ và bazơ tạo thành muối và nước. Ví dụ:
CuO + 2HCl CuCl2 + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
- Tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Ví dụ:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑
AgNO3 + HCl → AgCl↓ + HNO3
Ngoài tính chất đặc trưng là tính axit, dung dịch axit HCl đặc còn thể hiện tính khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3…
5. Cách thực hiện phản ứng
- CHo FeS vào dung dịch axit HCl
6. Bài tập liên quan
Câu 1: Nung nóng hỗn hợp bột gồm 1,5 mol Fe và 1 mol S trong môi trường không có không khí đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn X. Cho X tác dụng với dung dịch HCl dư thu được khí Y. Thành phần của khí Y là
A. H2S.
B. H2.
C. H2S và SO2.
D. H2S và H2.
Hướng dẫn giải:
Đáp án D
Fe + S FeS
Bđ: 1,5 1 mol
Pư: 1dư 0,5 ← 1 → 1 mol
Vậy chất rắn X gồm Fe dư và FeS
⇒ Khí Y gồm H2 và H2S
Câu 2: Nung hỗn hợp X gồm m gam Fe và a gam S ở nhiệt độ cao, sau một thời gian thu được chất rắn Y. Cho Y vào dung dịch HCl dư thu được 2,688 lít hỗn hợp khí Z và còn lại một chất rắn không tan. Giá trị của m là
A. 11,20
B. 6,72
C. 5,60
D. 22,40
Hướng dẫn giải
Đáp án B
Ta có: nZ = 0,12 mol
Bảo toàn nguyên tố H:
→ nHCl = 0,24 mol
Bảo toàn nguyên tố Cl:
Bảo toàn nguyên tố Fe:
→mFe = 6,72g
Câu 3: Hấp thụ 7,84 lít (đktc) khí H2S vào 64 gam dung dịch CuSO4 10%, sau phản ứng hoàn toàn thu được m gam kết tủa đen. Gía trị của m là:
A. 33,6 gam
B. 38,4 gam
C. 3,36 gam
D. 3,84 gam
Hướng dẫn giải:
Đáp án A
Phương trình phản ứng:
H2S + CuSO4 →CuS↓+ H2SO4.
Ta có:
⇒ H2S dư và CuSO4 hết.
Câu 4: Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và FeS trong dung dịch HCl dư thu được dung dịch Y và thoát ra 4,928 lít hỗn hợp khí Z. Cho hỗn hợp khí Z qua dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa đen. Thành phần phần trăm về khối lượng của FeS trong hỗn hợp X gần nhất với giá trị nào sau đây?
A. 94%.
B. 6%
C. 60%
D. 40%
Hướng dẫn giải:
Đáp án A
Gọi x, y lần lượt là số mol Fe, FeS trong hỗn hợp X.
Phương trình phản ứng:
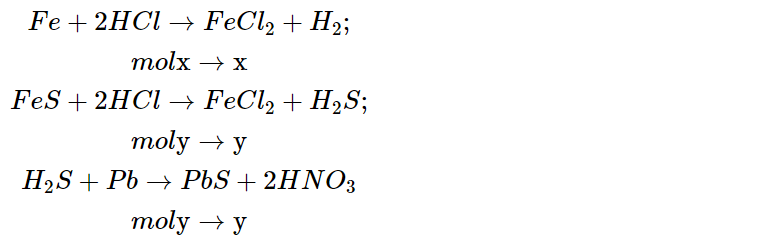
Ta có:
Câu 5: Nung 5,6 gam bột sắt và 13 gam kẽm với một lượng dư bột lưu huỳnh, sau phản ứng thu được rắn X. Hòa tan hoàn toàn X trong dung dịch axit clohidric thu được khí Y. Dẫn khí Y vào V lít dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được m gam kết tủa. Gía trị của m là:
A. 9,6 gam
B. 19,2 gam
C. 18,6 gam
D. 28,8 gam
Hướng dẫn giải:
Đáp án D
Phương trình phản ứng:
Fe + S FeS
Zn + S ZnS
FeS + 2HCl FeCl2 + H2S
ZnS + 2HCl ZnCl2 + H2S
H2S + CuSO4 CuS + H2SO4
Ta có:
Câu 6: Hoà tan hoàn toàn m gam hỗn hợp gồm Fe và FeS bằng dung dịch HCl thấy thoát ra 8,96 lít (đkc) hỗn hợp khí X. Dẫn hỗn hợp khí X đi qua dung dịch CuCl2 dư, tạo ra 9,6 gam kết tủa. Giá trị m gam hỗn hợp đã dùng là
A. 16,8 gam.
B. 18,6 gam.
C. 25,6 gam.
D. 26,5 gam.
Hướng dẫn giải:
Đáp án C
Sơ đồ bài toán:
Bảo toàn nguyên tố lưu huỳnh:
Bảo toàn electron:
⇒ nFe = 0,3 mol ⇒ m = 0,3.56 + 0,1.88 = 25,6 gam.
Câu 7. Để trung hòa 20 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ x mol/l. Giá trị của x là
A. 0,3.
B. 0,4.
C. 0,2.
D. 0,1.
Hướng dẫn giải
Đáp án C
nHCl = 0,1.0,02 = 0,002 mol
HCl + NaOH → NaCl + H2O
0,002 → 0,002 mol
Câu 8: Cho 36 gam FeO phản ứng vừa đủ với dung dịch chứa a mol HCl. Giá trị của a là
A. 1,00.
B. 0,50.
C. 0,75.
D. 1,25.
Hướng dẫn giải
Đáp án A
2HCl + FeO → FeCl2 + H2O
Theo PTHH: nHCl = 2nFeO = 1mol
Câu 9. Cần dùng 300 gam dung dịch HCl 3,65% để hòa tan vừa hết x gam Al2O3. Giá trị của x là
A. 51.
B. 5,1.
C. 153.
D. 15,3.
Hướng dẫn giải
Đáp án B
6HCl + Al2O3 → 2AlCl3 + 3H2O
0,3 → 0,05 mol
= 0,05.102 = 5,1 gam
Câu 10. Cho 5,6 gam một oxit kim loại tác dụng vừa đủ với HCl cho 11,1 gam muối clorua của kim loại đó. Cho biết công thức oxit kim loại?
A. Al2O3.
B. CaO.
C. CuO.
D. FeO.
Hướng dẫn giải
Đáp án B
Gọi công thức oxit là M2Oa
2aHCl + M2Oa → 2MCla + aH2O
Gọi số mol H2O là x (mol)⇒ nHCl = 2x (mol)
Bảo toàn khối lượng: 36,5.2x + 5,6 = 11,1 + 18.x
⇒ x = 0,1 mol
| a | 1 | 2 | 3 |
| M | 20 | 40 | 60 |
| Kết luận | Loại | Ca | Loại |
Câu 11. Cho 30,00 gam hỗn hợp X gồm Fe và FeO phản ứng với dung dịch HCl dư, đến khi phản ứng xảy ra hoàn toàn thu được 6,72 lít khí H2 (đktc). Khối lượng của FeO trong 30,00 gam hỗn hợp X là
A. 13,2 gam.
B. 46,8 gam.
C. 16,8 gam.
D. 5,6 gam.
Hướng dẫn giải
Đáp án A
2HCl + FeO → FeCl2 + H2O
2HCl + Fe → FeCl2 + H2
Theo PTHH:
nFe = nkhí = 0,3 mol ⇒ mFeO = 30 – 0,3.56 = 13,2 gam.
Câu 12. Để hoà tan hết hỗn hợp Zn và ZnO phải dùng 100,8 ml dung dịch HCl 36,5% (D = 1,19g/ml) thu được 0,4 mol khí. Phần trăm về khối lượng hỗn hợp Zn và ZnO ban đầu lần lượt là
A. 40% và 60%.
B. 45% và 55%.
C. 50% và 50%
D. 61,6% và 38,4%.
Hướng dẫn giải
Đáp án D
2HCl + ZnO → ZnCl2 + H2O (1)
2HCl + Zn → ZnCl2 + H2 (2)
Theo PTHH (2):
nHCl (2) = 2.nZn = 0,8 mol ⇒ nHCl (1) = 1,2 – 0,8 = 0,4 mol
mhỗn hợp = 0,4.65 + 0,2.81 = 42,2 gam
7. Một số phương trình phản ứng hoá học khác của Sắt (Fe) và hợp chất:
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
FeS + 6HNO3 → 2H2O + H2SO4 + 3NO ↑ + Fe(NO3)3
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
2FeS2 + 14H2SO4 đặc → Fe2(SO4)3 + 15SO2↑ + 14H2O
Phương trình nhiệt phân: FeCO3 → FeO + CO2↑