Tailieumoi.vn xin giới thiệu phương trình 4FeS2 + 11O2 2Fe2O3 + 8SO2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Sắt. Mời các bạn đón xem:
Phương trình 4FeS2 + 11O2 2Fe2O3 + 8SO2
1. Phương trình phản ứng hóa học
4FeS2 + 11O2 2Fe2O3 + 8SO2↑
2. Hiện tượng nhận biết xảy ra phản ứng
Có khí thoát ra, xuất hiện oxit Fe2O3
3. Điều kiện xảy ra phản ứng
Đốt ở nhiệt độ cao.
4. Tính chất hoá học
4.1. Tính chất hoá học của FeS2
- Mang tính chất hóa học của muối.
- Thể hiện tính khử khi tác dụng với chất oxi hóa mạnh:
Tác dụng với axit:
FeS2 + 8HNO3 → 2H2O + 2H2SO4 + 5NO + Fe(NO3)3
FeS2 + 2HCl → FeCl2 + H2S + S
Tác dụng với oxi:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
4.2. Tính chất hoá học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
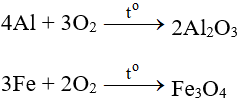
Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
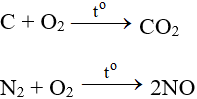
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
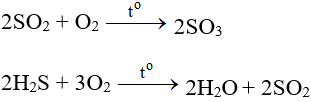
- Tác dụng với các chất hữu cơ:
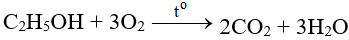
5. Cách thực hiện phản ứng
- Cho FeS2 tác dụng với oxi
6. Bài tập liên quan
Câu 1: Cho các chất: FeS, FeS2 , FeO, Fe2O3. Chất chứa hàm lượng sắt lớn nhất là:
A. FeS
B. FeS2
C. FeO
D. Fe2O3
Hướng dẫn giải
Đáp án C
Hàm lượng Fe trong FeO là lớn nhất:
%Fe = = 77,78%
Câu 2. Dãy các chất nào sau đây tác dụng với dung dịch axit sunfuric loãng?
A. Fe2O3, CuO, Al2O3, MgO
B. Fe2O3, CuO, Al2O3, CO
C. P2O5, CuO, Al2O3, MgO
D. P2O5, CuO, SO3, MgO
Hướng dẫn giải
Đáp án A
Dãy các chất tác dụng với dung dịch axit sunfuric loãng: Fe2O3, CuO, Al2O3, MgO
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
CuO + H2SO4 → CuSO4 + H2O
MgO + H2SO4 → MgSO4 + H2O
Al2O3 + 3H 2SO4 → Al2(SO4)3 + 3H2O
Câu 3. Hòa tan một oxit sắt vào dung dịch H2SO4 loãng dư được dung dịch X.
Chia dung dịch X làm 2 phần bằng nhau:
- Phần 1: Cho một ít vụn Cu vào thấy tan ra và cho dung dịch có màu xanh
- Phần 2: Cho một vài giọt dung dịch KMnO4 vào thấy bị mất màu.
Oxit sắt là
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. FeO hoặc Fe2O3.
Hướng dẫn giải
Đáp án B
Cho Cu vào dung dịch thấy tan ra và có màu xanh chứng tỏ trong dung dịch có Fe3+:
Cu + 2Fe3+ → 2Fe2+ + Cu2+
Cho KMnO4 vào thấy dung dịch bị mất màu → chứng tỏ dung dịch có cả Fe2+ (xảy ra phản ứng oxi hóa khử giữa Fe2+ và KMnO4 do Mn+7 + 5e → Mn+2 và Fe+2 → Fe+3 + 1e.
Câu 4. Từ 1,6 tấn quặng pirit sắt có chứa 60% FeS2 có thể sản xuất được bao nhiêu tấn axit H2SO4? Biết hiệu suất của quá trình phản ứng là 90%. Kết quả gần nhất với đáp án nào sau đây?
A. 1,4 tấn
B. 1,5 tấn
C. 1,6 tấn
D. 1,5 tấn
Hướng dẫn giải
Đáp án A
Sơ đồ phản ứng: FeS2 → 2SO2 → 2SO3 → 2H2SO4
120 196
1,6.60% = 0,96 tấn → 1,568 tấn
=> khối lượng axit sunfuric thực tế thu được = 1,568.90% = 1,2544 tấn = 1411,2 kg
Đáp án cần chọn là: A
Câu 5: Dùng 300 tấn quặng pirit (FeS2) có lẫn 20% tạp chất để sản xuất axit H2SO4 có nồng độ 98%. Biết rằng hiệu suất phản ứng là 90%. Khối lượng axit H2SO4 98% thu được là
A. 320 tấn
B. 335 tấn
C. 350 tấn
D. 360 tấn
Hướng dẫn giải:
Đáp án D
Ta có sơ đồ :
FeS2 →2SO2 →2SO3 →2H2SO4
120 → 2.98 gam
300.0,8 → x tấn
→ Theo lý thuyết thì: tấn
Thực tế thì tấn
Câu 6: Từ 800 tấn quặng pirit sắt (FeS2) chứa 25% tạp chất không cháy, có thể sản xuất được bao nhiêu m3 dung dịch H2SO4 93% (D = 1,83 g/ml)? Giả thiết tỉ lệ hao hụt là 5%.
A. 547m3
B. 574 m3
C. 647m3
D. 674 m3
Hướng dẫn giải:
Đáp án A
= 800.75% = 600 tấn
Sơ đồ sản xuất H2SO4 từ FeS2:
FeS2 →2SO2 →2SO3 →2H2SO4
120 tấn 2.98 = 196 tấn
600 → 980 tấn
Do hao hụt 5% (hiệu suất 95%) nên lượng H2SO4 thu được là:
= 980.95% = 931 tấn
Câu 7. Hòa tan Fe3O4 vào dung dịch HCl được dung dịch X. Chia X làm 3 phần:
Thêm NaOH dư vào phần 1 được kết tủa Y. Lấy Y để ngoài không khí.
Cho bột Cu vào phần 2.
Sục Cl2 vào phần 3.
Trong các quá trình trên có số phản ứng oxi hoá - khử là
A. 2.
B. 3.
C. 4.
D. 5
Đáp án B
Phương trình phản ứng
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
X gồm FeCl2 và FeCl3
Cho phần 1 tác dụng với dung dịch NaOH:
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Y gồm: Fe(OH)2 và Fe(OH)3.
Sau khi để Y ngoài không khí: 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Cho phần 2 vào Cu: Cu + 2FeCl3 → 2FeCl2 + 2CuCl2
Cho phần 3 vào Cl2: 2FeCl2 + Cl2 → 2FeCl3.
Câu 8. Để nhận biết khí O2 và O3 ta sử dụng hóa chất nào sau đây?
A. Dung dịch KI và hồ tinh bột
B. Kim loại Fe
C. Đốt cháy cacbon
D. Tác dụng với SO2
Đáp án A
Dẫn lần lượt hai khí vào 2 dung dịch KI có chứa sẵn một ít tinh bột
Mẫu thử nào có dung dịch có màu xanh xuất hiện thì khí dẫn là ozon.
2KI + O3 + H2O → I2+ O2 + KOH
I2 + hồ tinh bột → xanh
Khí còn lại không làm đổi màu là oxi
Câu 9. Oxit nào sau đây khi tác dụng với nước tạo ra dung dịch có pH > 7?
A. CO2
B. SO2
C. CaO
D. P2O5
Đáp án C
Câu 10. Để nhận biết 3 khí không màu: SO2, O2, H2 đựng trong 3 lọ mất nhãn ta dùng:
A . Giấy quỳ tím ẩm
B . Giấy quỳ tím ẩm và dùng que đóm cháy dở còn tàn đỏ
C . Than hồng trên que đóm
D . Dẫn các khí vào nước vôi trong
Đáp án B
Giấy quỳ tím ẩm thì nhận biết được SO2 do SO2 tan trong nước tạo dung dịch axit làm quỳ hóa đỏ
Dùng que đóm cháy dở còn tàn đỏ nhận biết được khí O2 vì Oxi là chất duy trì sự sống và sự cháy nên sẽ quan sát được hiện tượng là tàn đóm bùng cháy
Câu 11. Tại sao trong phòng thí nghiệm người ta lại sử dụng phương pháp đẩy nước
A. Oxi nặng hơn không khí
B. Oxi nhẹ hơn không khí
C. Oxi ít tan trong nước
D. Oxi tan nhiều trong nước
Đáp án C
7. Một số phương trình phản ứng hoá học khác của Sắt (Fe) và hợp chất:
FeS + 6HNO3 → 2H2O + H2SO4 + 3NO ↑ + Fe(NO3)3
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
2FeS2 + 14H2SO4 đặc → Fe2(SO4)3 + 15SO2↑ + 14H2O
Phương trình nhiệt phân: FeCO3 → FeO + CO2↑
FeCO3 + 4HNO3 → 2H2O + NO2 ↑+ Fe(NO3)3 + CO2 ↑
2FeCO3 + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 2CO2↑ + 4H2O