Tailieumoi.vn xin giới thiệu phương trình 2FeCl3 + 6H2O + 6Na → 3H2 ↑+ 6NaCl + 2Fe(OH)3↓ gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Sắt. Mời các bạn đón xem:
Phương trình 2FeCl3 + 6H2O + 6Na → 3H2 ↑+ 6NaCl + 2Fe(OH)3↓
1. Phương trình phản ứng hóa học
2FeCl3 + 6H2O + 6Na → 3H2 ↑+ 6NaCl + 2Fe(OH)3↓
2. Hiện tượng nhận biết phản ứng
- Xuất hiện kết tủa nâu đỏ Fe(OH)3 và có khí H2 thoát ra
3. Điều kiện phản ứng
- Nhiệt độ phòng.
4. Tính chất hoá học
4.1. Tính chất hoá học của FeCl3
- Tính chất hóa học của muối:
- Có tính oxi hóa: Khi tác dụng với chất khử, hợp chất sắt (III) clorua bị khử thành hợp chất sắt (II) hoặc kim loại sắt tự do.
Fe3+ + 1e → Fe2+
Fe3+ + 3e → Fe
Tính chất hóa học của muối:
- Tác dụng với dung dịch kiềm:
FeCl3 + 3KOH → Fe(OH)3 + 3KCl
- Tác dụng với muối
FeCl3 + 3AgNO3 → Fe(NO3)3 + 3AgCl
- Tác dụng với dung dịch axit:
- Sục khí H2S vào dung dịch FeCl3 có hiện tượng vẫn đục:
2FeCl3 + H2S → 2 FeCl2 + 2 HCl + S
Tính oxi hóa
Fe + 2FeCl3 → 3FeCl2
Cu + 2FeCl3 → 2FeCl2 + CuCl2
4.2. Tính chất hoá học của Natri
- Natri có tính khử rất mạnh: Na → Na+ + 1e
Tác dụng với phi kim
4Na + O2 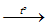
2Na + Cl2 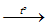
- Khi đốt trong không khí hay trong oxi, Na cháy tạo thành các oxit (oxit thường, peoxit và supeoxit) và cho ngọn lửa có màu vàng đặc trưng.
Tác dụng với axit
- Natri dễ dàng khử ion H+ trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Na + 2HCl → 2NaCl + H2.
2Na + H2SO4 → Na2SO4 + H2.
Tác dụng với nước
- Natri đều tác dụng mãnh liệt với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Na + 2H2O → 2NaOH + H2.
Tác dụng với hidro
- Natri tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành natri hidrua.
2Na (lỏng) + H2 (khí) 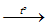
4.3. Tính chất hoá học của nước
– Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
K + H2O → KOH + H2
– Tác dụng với một số oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
CaO + H2O → Ca(OH)2
– Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
SO3 + H2O → H2SO4
5. Cách thực hiện phản ứng
- Cho FeCl3 tác dụng với Na trong H2O
6. Bạn có biết
Tương tự FeCl3, FeCl2 cũng có phản ứng với Na trong nước tạo kết tủa Fe(OH)2
7. Bài tập liên quan
Ví dụ 1: Xác định hiện tượng đúng khi đốt dây thép trong oxi.
A. Thấy xuất hiện muội than màu đen.
B. Dây thép cháy sáng mạnh.
C. Dây thép cháy sáng mạnh tạo thành những tia sáng bắn tóe ra đồng thời có các hạt màu nâu sinh ra.
D. Dây thép cháy sáng lên rồi tắt ngay.
Hướng dẫn giải
Đáp án : C
Ví dụ 2: Phản ứng nào sau đây xảy ra:
A. Fe + CuSO4 → FeSO4 + Cu
B. Fe + ZnSO4 → FeSO4 + Zn
C. 2Fe + 3CuSO4 → Fe2(SO4)3 + 3Cu
D. 2Ag + Fe(NO3)2 → 2AgNO3 + Fe
Hướng dẫn giải
Kim loại đứng trước trong dãy hoạt động hóa học sẽ đẩy được muối của kim loại đứng sau ra khỏi dung dịch.
Đáp án : A
Ví dụ 3: Để tách Ag ra khỏi hỗn hợp Ag, Cu, Fe mà khối lượng Ag không thay đổi thì dùng chất nào sau đây ?
A. FeSO4
B. CuSO4
C. Fe2(SO4)3
D. AgNO3
Hướng dẫn giải
Fe + Fe2(SO4)3 → 3FeSO4
Cu + Fe2(SO4)3 → 3FeSO4 + CuSO4
Đáp án : C
8. Một số phương trình phản ứng hoá học khác của Sắt (Fe) và hợp chất:
2FeCl3 + 6H2O + 6K → 3H2 ↑ + 6KCl + 2Fe(OH)3↓
2FeCl3 + 6H2O + 3Ba → 3BaCl2 + 2H2 ↑ + 2Fe(OH)3↓
2FeCl3 + 6H2O + 3Ca → 3CaCl2 + 2H2 ↑ + 2Fe(OH)3↓
FeCl3 + 3H2O + 3NH3 → 3NH4Cl + Fe(OH)3↓
2FeCl3 + 3H2O + 3K2CO3 → 6KCl + 3CO2 ↑ + 2Fe(OH)3↓
2FeCl3 + 3H2O + 3Na2CO3 → 6NaCl + 3CO2 ↑ + 2Fe(OH)3↓
2FeCl3 + 2H2O + SO2 → 2FeCl2 + H2SO4 + 2HCl