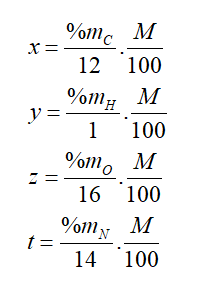Với giải Luyện tập trang 58 Hóa học lớp 11 Chân trời sáng tạo chi tiết trong Bài 10: Công thức phân tử hợp chất hữu cơ giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 10: Công thức phân tử hợp chất hữu cơ
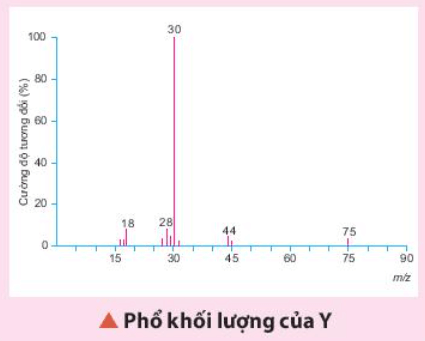
Luyện tập trang 58 Hóa học 11: Một hợp chất hữu cơ Y có 32% C; 6,67% H; 18,67% N về khối lượng còn lại là O. Phân tử khối của hợp chất này được xác định thông qua kết quả phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất. Lập công thức phân tử của Y.
Lời giải:
%mO = 100% - 32% - 6,67% - 18,67% = 42,66%.
Đặt công thức phân tử của Y là CxHyOzNt.
Từ phổ khối lượng của Y xác định được: MY = 75.
Vậy:
Công thức phân tử của Y: C2H5O2N.
Lý thuyết Công thức phân tử hợp chất hữu cơ
- Để lập công thức phân tử hợp chất hữu cơ (CxHyOzNt), người ta có thể dựa vào dữ liệu phân tích nguyên tố và phân tử khối của hợp chất (M).
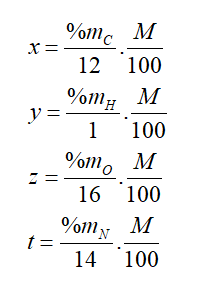
Với: + x, y, z, t lần lượt là số nguyên tử C, H, O và N.
+ %mC, %mH, %mO, %mN lần lượt là % khối lượng của các nguyên tố C, H, O, N trong hợp chất hữu cơ.
Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 57 Hóa học 11: Phổ khối lượng (Mass spectrometry – MS) thường được sử dụng để xác định nguyên tử khối, phân tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố với độ chính xác cao. Xác định được phân tử khối là một trong những yếu tố quan trọng trong việc lập công thức phân tử của hợp chất hữu cơ. Công thức phân tử hợp chất hữu cơ được lập như thế nào từ dữ liệu phân tích nguyên tố và phân tử khối?...
Câu hỏi thảo luận 1 trang 57 Hóa học 11: Quan sát Hình 10.1, xác định giá trị phân tử khối của naphthalene và phenol. Biết phân tử khối tương ứng với peak có cường độ tương đối lớn nhất hiển thị trên phổ khối lượng....
Câu hỏi thảo luận 2 trang 58 Hóa học 11: Từ phổ khối lượng, làm thế nào để xác định được phân tử khối của hợp chất hữu cơ cần khảo sát?...
Luyện tập trang 58 Hóa học 11: Một hợp chất hữu cơ Y có 32% C; 6,67% H; 18,67% N về khối lượng còn lại là O. Phân tử khối của hợp chất này được xác định thông qua kết quả phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất. Lập công thức phân tử của Y....
Bài 1 trang 59 Hóa học 11: Acetone là một hợp chất hữu cơ dùng để làm sạch dụng cụ trong phòng thí nghiệm, tẩy rửa sơn móng tay và là chất đầu trong nhiều quá trình tổng hợp hữu cơ. Kết quả phân tích nguyên tố của acetone như sau: 62,07% C; 27,59% O về khối lượng, còn lại là hydrogen. Phân tử khối của acetone được xác định thông qua phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất bằng 58. Lập công thức phân tử của acetone....
Bài 2 trang 60 Hóa học 11: Chất hữu cơ X được sử dụng khá rộng rãi trong ngành y tế với tác dụng chống vi khuẩn, vi sinh vật. Kết quả phân tích của nguyên tố X như sau: 52,17% C; 13,04% H về khối lượng, còn lại là oxygen. Phân tử khối của X được xác định thông qua kết quả phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất bằng 46. Lập công thức phân tử của X....
Bài 3 trang 60 Hóa học 11: Aniline là hợp chất quan trọng trong công nghiệp phẩm nhuộm và sản xuất polymer. Kết quả phân tích nguyên tố của aniline như sau: 77,42% C; 7,53% H về khối lượng, còn lại là nitrogen. Phân tử khối của aniline được xác định trên phổ khối lượng tương ứng với peak có cường độ tương đối mạnh nhất. Lập công thức phân tử của aniline....
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: