Tailieumoi.vn giới thiệu Giải bài tập Hóa Học lớp 11 Bài 2: Axit, bazơ và muối chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Axit, bazơ và muối lớp 11.
Giải bài tập Hóa Học 11 Bài 2: Axit, bazơ và muối
Theo thuyết A-rê-ni-ut thì:
1. Axit
- Axit là chất khi tan trong nước phân li ra cation H+.
Ví dụ: HCl → H+ + Cl–
+ Những axit mà tan trong nước phân li nhiều nấc ra ion H+ gọi là các axit nhiều nấc.
Ví dụ : H2SO4, H3PO4…
+ Những axit mà tan trong nước phân li 1 nấc ra ion H+ gọi là các axit một nấc.
2. Bazo
– Bazơ là chất khi tan trong nước phân li ra anion OH–.
Ví dụ : NaOH → Na+ + OH–
+ Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Zn(OH)2 ⇔ Zn2+ +2OH–
Zn(OH)2 ⇔ ZnO22- + 2H+
3. Muối
- Muối là hợp chất, khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit.
Ví dụ : Na2CO3 → 2Na+ + CO32-
+ Muối trung hòa là muối mà anion gốc axit không có khả năng phân li ra ion H+.
+ Muối axit là muối mà anion gốc axit có khá năng phân li ra ion H+.
d) hiđroxit lưỡng tính : Sn(OH)2.
a) H2S H+ + HS-
HS- H+ + S2-
H2CO3 H+ + HCO3-
HCO3- H + + CO32-
b) LiOH → Li+ + OH-
c) K2CO3 → 2K+ + CO32-
NaClO → Na+ + ClO-
NaHS → Na+ + HS-
HS- H+ + S2-
d) Sn(OH)2 Sn2++ 2OH-
H2SnO2 2H+ + SnO22-
Bài 3 trang 10 sgk hóa học 11: Theo thuyết A-rê-ni-ut, kết luận nào sau đây là đúng ?
A. Một hợp chất trong thành phẩn phân tử có hiđro là axit.
B. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
C. Một hợp chất có khả năng phân li ra cation H+ trong nước là axit.
D. Một bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
D sai vì bazơ là chất khi tan trong nước phân ly ra anion OH-, nên trong phân tử bazơ luôn có nhóm OH (định nghĩa theo thuyết Arrehnius)
Đáp án C
Bài 4 trang 10 sgk hóa học 11: Đối với dung dịch axit yếu CH3COOH 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng ?
A. [H+] = 0,10M
B. [H+] < [CH3COO-]
C. [H+] > [CH3COO-]
D. [H+] < 0,10M
Lời giải
Do CH3COOH là chất điện ly yếu nên trong nước chỉ phân ly một phần
CH3COOH CH3COO- + H+
Vậy [H+] = [CH3COO-] < 0,1M
Đáp án D
Bài 5 trang 10 sgk hóa học 11: Đối với dung dịch axit mạnh HNO3 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng ?
A. [H+] = 0,10M
B. [H+] < [NO3-]
C. [H+] > [NO3-]
D. [H+] < 0,10M
Lời giải
HNO3 là một axit mạnh nên khi hòa tan trong nước bị phân li hoàn toàn thành ion.
HNO3 H+ + NO3-
0,1 0,1 0,1
[H+] = [NO3-] = 0,1M
Vậy [H+] = 0,10M.
Đáp án A
1. Theo thuyết A-rê-ni-ut
- Axit là chất khi tan trong nước phân li ra cation H+
Ví dụ: HCl → H+ + Cl-
- Bazơ là chất khi tan trong nước phân li ra anion OH-
Ví dụ : NaOH → Na+ + OH-
- Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Ví dụ : Zn(OH)2 Zn2+ +2OH- ;
Zn(OH)2 ZnO2-2 + 2H+
2. Axit nhiều nấc, Bazo nhiều nấc
- Những axit mà tan trong nước phân li nhiều nấc ra ion H+ gọi là các axit nhiều nấc.
Ví dụ : H2SO4, H3PO4....
H3PO4 H+ + H2PO4–
H2PO4– H+ + HPO42–
HPO42– H+ + PO43–
- Những bazơ khi tan trong nước phân li nhiều nấc ra ion OH- gọi là các bazơ nhiều nấc. Ví dụ : Mg(OH)2, Ca(OH)2,....
Ví dụ:
Mg(OH)2 → Mg(OH)+ + OH-
Mg(OH)+ → Mg2+ + OH-
3. Muối
- Là hợp chất, khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit.
Ví dụ:
Na2CO3 → 2Na+ + CO32-
- Muối trung hòa là muối mà anion gốc axit không có khả năng phân li ra ion H+.
Ví dụ: NaCl, (NH4)2SO4…
- Muối axit là muối mà anion gốc axit có khá năng phân li ra ion H+.
Ví dụ: KHSO4, NaHCO3, NaH2PO4…
NaHSO4 → Na+ + HSO4-
HSO4- → H+ + SO42-
- Sự điện li cùa muối trong nước tạo cation kim loại (hoặc NH4+ , ion phức) và anion gốc axit.
Sơ đồ tư duy: Axit, bazơ và muối.
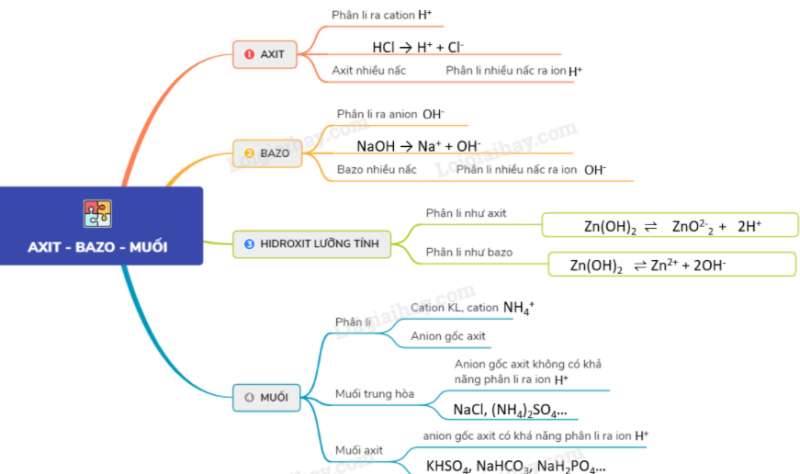
* Một số lưu ý cần nhớ:
- Axit là chất khi tan trong nước phân li ra H+
- Bazo là chất khi tan trong nước phân li ra OH-
- Hidroxit lưỡng tính khi tan trong nước vừa có thể phân li theo kiểu axit, vừa phân li theo kiểu bazo
- Muối là hợp chất khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit
* Một số ví dụ điển hình:
Ví dụ 1: Trong dung dịch axit nitric (bỏ qua sự phân li của H2O) có những phần tử nào ?
A. H+, NO3-.
B. H+, NO3-, H2O.
C. H+, NO3-, HNO3.
D. H+, NO3-, HNO3, H2O.
Hướng dẫn giải chi tiết:
Ta có phương trinh điện li: HNO3 → H+ + NO3-
Đáp án B.
Ví dụ 2: Chọn các chất là hiđroxit lưỡng tính trong số các hiđroxit sau :
A. Zn(OH)2, Cu(OH)2.
B. Al(OH)3, Cr(OH)2
C. Sn(OH)2, Pb(OH)2.
D. Cả A, B, C.
Hướng dẫn giải chi tiết:
Hidroxit lưỡng tính khi tan trong nước vừa có thể phân li theo kiểu axit, vừa phân li theo kiểu bazo
Các hidroxit lưỡng tính thường gặp là: Zn(OH)2, Cu(OH)2 Al(OH)3, Cr(OH)2 Sn(OH)2, Pb(OH)2.
Đáp án D
Ví dụ 3: Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh ?
A. NaCl.
B. NH4Cl.
C. Na2CO3.
D. FeCl3.
Hướng dẫn giải chi tiết:
Na2CO3 là muối của kim loại mạnh và gốc axit yếu nên khi thả quỳ tím vào dung dịch muối này sẽ khiến quỳ tím chuyển sang màu xanh.
Đáp án C.
Ví dụ 4: Dãy chất và ion nào sau đây có tính chất lưỡng tính?
A. Cl–, Na+, NH4+, H2O
B. ZnO, Al2O3, H2O
C. Cl–, Na+
D. NH4+, Cl–, H2O
Hướng dẫn giải chi tiết:
A : loại do Na+, Cl- là các ion trung tính; NH4+ là ion có tính axit
C: loại do Na+; Cl- đều là các ion trung tính.
D: loại do NH4+ là ion có tính axit; Cl- là ion trung tính.
Đáp án B.
Ví dụ 5: Hãy cho biết dãy các dung dịch nào sau đây có khả năng đổi màu quỳ tím sang đỏ (hồng) ?
A. CH3COOH, HCl và BaCl2.
B. NaOH, Na2CO3 và Na2SO3.
C. H2SO4, NaHCO3 và AlCl3 .
D. NaHSO4, HCl và AlCl3.
Hướng dẫn giải chi tiết:
Chất có khả năng chuyển màu quì tím sang hồng là những chất có môi trường axit
=> Các chất đó có thể là: NaHSO4, HCl, AlCl3
A loại BaCl2 có môi trường trung tính
B chỉ gồm các chất có môi trường bazo
C lại NaHCO3 có môi trường bazo
Đáp án D.