Tailieumoi.vn xin giới thiệu phương trình 4CrO + O2 → 2Cr2O3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Crom. Mời các bạn đón xem:
Phương trình 4CrO + O2 → 2Cr2O3
1. Phương trình phản ứng hóa học:
4CrO + O2 → 2Cr2O3
2. Hiện tượng nhận biết phản ứng
- Chất rắn chuyển dần sang màu lục
3. Điều kiện phản ứng
- Nhiệt độ.
4. Tính chất hoá học
4.1. Tính chất hoá học của CrO
- Mang tính chất của oxit bazơ.
- Có tính khử.
Tính chất của oxit bazơ.
Tác dụng với axit:
CrO + 2HCl → CrCl2 + H2O
CrO + H2SO4 → CrSO4 + H2O
Tính khử
Tác dụng với oxi:
4CrO + O2 → 2Cr2O3
Tác dụng với các axit: HNO3 loãng hoặc HNO3 đặc nóng và H2SO4 đặc nóng,
3CrO + 10HNO3 → 3Cr(NO3)3 + NO + 5H2O.
4.2. Tính chất hoá học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
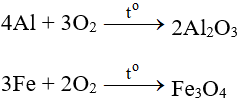
Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
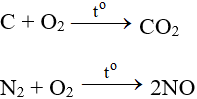
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
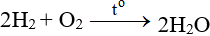
Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
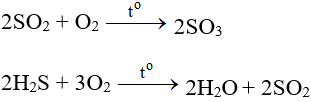
- Tác dụng với các chất hữu cơ:
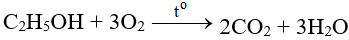
5. Cách thực hiện phản ứng
- Cho oxit CrO vào ống nghiệm sau đó đun nóng trên ngọn lửa đèn cồn.
6. Bạn có biết
- CrO là 1 oxit có tính khử, trong không khí dễ dàng bị oxi hóa tạo thành Cr2O3..
7. Bài tập liên quan
Ví dụ 1: Crom (II) oxit là oxit
A. có tính bazo
B. có tính khử
C. có tính oxi hóa
D. vừa có tính khử, vừa có tính bazo, vừa có tính oxi hóa
Hướng dẫn giải
Đáp án D
CrO là oxit bazo nên có tính bazo, trong hợp chất CrO crom có số OXH là +2 nên có tính oxi hóa và tính khử.
Ví dụ 2: Trong không khí CrO dễ bị oxi hóa thành
A. CrO3
B. Cr2O3
C. Cr
D. CrO2
Hướng dẫn giải
Đáp án B
8. Một số phương trình phản ứng hoá học khác của Crom (Cr) và hợp chất:
4CrO3 + C2H5OH → 2CO2↑ + 2Cr2O3 + 3H2O
2CrO3 + 2NH3 → N2↑ + Cr2O3 + 3H2O
Cr2O3 + 6HCl(đặc) → 2CrCl3 + 3H2O