Với giải Câu hỏi 1 trang 27 KHTN lớp 8 Kết nối tri thức chi tiết trong Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Khoa học tự nhiên 8. Mời các bạn đón xem:
Giải bài tập KHTN lớp 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
Câu hỏi 1 trang 27 KHTN 8: Sơ đồ của phản ứng hoá học khác với phương trình hoá học ở điểm nào? Nêu ý nghĩa của phương trình hoá học.
Trả lời:
- Sơ đồ của phản ứng hoá học khác với phương trình hoá học ở điểm: sơ đồ hoá học chưa cho biết tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất trong phản ứng.
- Ý nghĩa của phương trình hoá học: Phương trình hoá học cho biết trong phản ứng hoá học, lượng các chất tham gia phản ứng và các chất sản phẩm tuân theo một tỉ lệ xác định.
Lý thuyết Phương trình hóa học
- Phương trình hoá học của phản ứng giữa khí hydrogen và khí oxygen là:
2H2 + O2 → 2H2O
- Trong phản ứng hoá học, tổng số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng luôn bằng tổng số nguyên tử của nguyên tố đó trong các chất sản phẩm. Sau khi cân bằng, tổng số nguyên tử của mỗi nguyên tố ở hai vẽ của sơ đồ phản ứng bằng nhau, ta được PTHH.
- Các bước lập phương trình hoá học:
Bước 1: Viết sơ đồ của phản ứng:
Al + O2 Al2O3
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố ở 2 vế. Với trường hợp này, ta cần đặt hệ số 2 trước Al2O3 và hệ số 3 trước O2:
4Al + 3O2 2Al2O3
Bước 3: Viết phương trình hoá học của phản ứng:
4Al + 3O2 2Al2O3
Lưu ý:
- Hệ số viết ngang với kí hiệu của các chất.
- Không thay đổi các chỉ số trong các công thức hoá học đã viết đúng.
- Nếu trong công thức hoá học, các chất ở 2 vế có những nhóm nguyên tử giống nhau, ta coi nhóm nguyên tử này như một "nguyên tố để cân bằng".
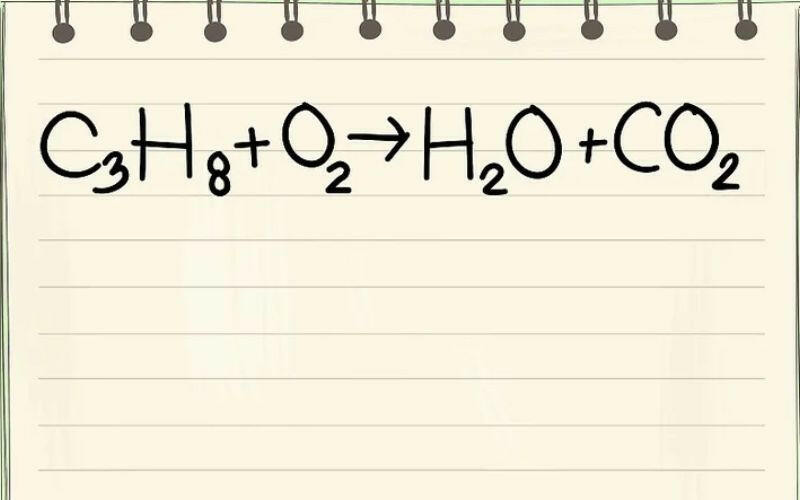
2. Ý nghĩa của phương trình hoá học
Phương trình hoá học thể hiện tỉ lệ số mol giữa các chất tham gia và sản phẩm trong một phản ứng hoá học. Từ đó, ta có thể xác định được tỉ lệ hệ số của các chất trong phản ứng và tỉ lệ số mol, cũng như tỉ lệ khối lượng của chúng. Ví dụ: Trong phản ứng 4Al + 3O2 --> 2Al2O3, ta biết được rằng để phản ứng hoàn toàn, cần sử dụng 4 mol nhôm với 3 mol oxi, tạo ra 2 mol nhôm oxit. Từ đó, ta có thể tính toán được tỉ lệ số mol và khối lượng giữa các chất trong phản ứng.
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 8 Kết nối tri thức hay, chi tiết khác:
Câu hỏi trang 25 KHTN 8: Carbon tác dụng với oxygen theo sơ đồ Hình 5.1:...
Hoạt động trang 26 KHTN 8: Lập phương trình hoá học của các phản ứng sau:...
Xem thêm các bài giải SGK Khoa học tự nhiên lớp 8 Kết nối tri thức hay, chi tiết khác: