Tailieumoi.vn giới thiệu Giải bài tập Khoa học tự nhiên lớp 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học chi tiết sách Kết nối tri thức giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn KHTN 8. Mời các bạn đón xem:
Giải bài tập KHTN lớp 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
Giải KHTN 8 trang 24
Trả lời:
Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng. Hay tổng khối lượng của chất trước và sau phản ứng không thay đổi.
I. Định luật bảo toàn khối lượng
Tiến hành:
- Trên mặt cân đặt 2 cốc: cốc (1) đựng dung dịch barium chloride, cốc (2) đựng dung dịch sodium sulfate. Ghi tổng khối lượng 2 cốc.
- Đổ cốc (1) vào cốc (2), lắc nhẹ để hai dung dịch trộn lẫn với nhau. Quan sát thấy có một chất rắn màu trắng xuất hiện ở cốc (2). Phản ứng xảy ra như sau:
Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride
Đặt 2 cốc trở lại mặt cân. Ghi khối lượng.
Thực hiện yêu cầu sau:
So sánh tổng khối lượng của các chất trước phản ứng với tổng khối lượng của các chất sau phản ứng.
Trả lời:
Học sinh làm thí nghiệm và rút ra kết luận: Tổng khối lượng của các chất trước phản ứng bằng tổng khối lượng của các chất sau phản ứng.
Giải KHTN 8 trang 25
Câu hỏi trang 25 KHTN 8: Carbon tác dụng với oxygen theo sơ đồ Hình 5.1:
Giải thích tại sao khối lượng carbon dioxide bằng tổng khối lượng carbon và oxygen.
Trả lời:
Khối lượng carbon dioxide bằng tổng khối lượng carbon và oxygen do trong phản ứng hoá học chỉ có liên kết giữa các nguyên tử thay đổi, còn số nguyên tử của mỗi nguyên tố hoá học vẫn giữ nguyên.
Trả lời:
Xỉ than nhẹ hơn than tổ ong. Do sau khi đốt cháy than tổ ong (thành phần chính là carbon) sản phầm thu được ngoài xỉ than còn có các khí (thành phần chứa nguyên tố carbon) là carbon monoxide; carbon dioxide.
Calcium oxide + Carbon dioxide → Calcium carbonate
Calcium oxide + Nước → Calcium hydroxide
Trả lời:
Sau một thời gian mở nắp lọ, vôi sống sẽ phản ứng với một số chất có mặt trong không khí như carbon dioxide, hơi nước … tạo thành các chất mới có khối lượng lớn hơn khối lượng vôi sống ban đầu. Do đó khối lượng của lọ sẽ tăng lên.
Hoạt động trang 26 KHTN 8: Lập phương trình hoá học của các phản ứng sau:
c) Al2(SO4)3 + NaOH − − → Al(OH)3 + Na2SO4
d) CaCO3 + HCl − − → CaCl2 + CO2 + H2O
Trả lời:
a) Fe + O2 − − → Fe3O4
Số nguyên tử Fe và O ở hai vế không bằng nhau, nhưng O có số nguyên tử nhiều hơn nên ta bắt đầu từ nguyên tố này trước. Do O2 có 2 nguyên tử O còn Fe3O4 có 4 nguyên tử O nên ta đặt hệ số 2 trước O2; để cân bằng tiếp số nguyên tử Fe ta đặt hệ số 3 vào trước Fe ở vế trái. Phương trình hoá học của phản ứng hoàn thiện như sau:
3Fe + 2O2 → Fe3O4.
b) Al + HCl − − → AlCl3 + H2
Trước phản ứng có 1 nguyên tử H và 1 nguyên tử Cl trong phân tử HCl; sau phản ứng có 3 nguyên tử Cl trong AlCl3; 2 nguyên tử H trong phân tử H2, do đó ta lấy bội chung nhỏ nhất của 3 và 2 là 6, đặt trước HCl, được:
Al + 6HCl − − → AlCl3 + H2
Để cân bằng số nguyên tử H ta đặt hệ số 3 trước H2; để cân bằng số nguyên tử Cl ta đặt hệ số 2 trước AlCl3, được:
Al + 6HCl − − → 2AlCl3 + 3H2
Cuối cùng để cân bằng số nguyên tử Al ta thêm hệ số 2 trước Al ở vế trái. Phương trình hoá học của phản ứng được hoàn thiện như sau:
2Al + 6HCl → 2AlCl3 + 3H2
c) Al2(SO4)3 + NaOH − − → Al(OH)3 + Na2SO4
Trước tiên ta cân bằng nhóm (SO4) bằng cách đặt hệ số 3 vào trước Na2SO4:
Al2(SO4)3 + NaOH − − → Al(OH)3 + 3Na2SO4
Để cân bằng tiếp số nguyên tử Na ta thêm hệ số 6 vào trước NaOH.
Al2(SO4)3 + 6NaOH − − → Al(OH)3 + 3Na2SO4
Cuối cùng thêm hệ số 2 trước Al(OH)3 để đảm bảo cân bằng số nguyên tử Al và nhóm (OH), khi đó phương trình hoá học được thiết lập:
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
d) CaCO3 + HCl − − → CaCl2 + CO2 + H2O
Ta thấy trước phản ứng có 1 nguyên tử H; 1 nguyên tử Cl trong phân tử HCl; Sau phản ứng có 2 nguyên tử Cl trong CaCl2; 2 nguyên tử H trong H2O. Để cân bằng số nguyên tử H và Cl ta thêm hệ số 2 trước HCl.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Kiểm tra lại thấy các nguyên tử đã được cân bằng, phương trình hoá học được hoàn thiện.
Trả lời:
- Sơ đồ của phản ứng hoá học khác với phương trình hoá học ở điểm: sơ đồ hoá học chưa cho biết tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất trong phản ứng.
- Ý nghĩa của phương trình hoá học: Phương trình hoá học cho biết trong phản ứng hoá học, lượng các chất tham gia phản ứng và các chất sản phẩm tuân theo một tỉ lệ xác định.
Na2CO3 + Ba(OH)2 − − → BaCO3 + NaOH
Trả lời:
Ta có bảng sau:
|
Nguyên tử/ nhóm nguyên tử |
Na |
(CO3) |
Ba |
(OH) |
|
Trước phản ứng (số lượng) |
2 |
1 |
1 |
2 |
|
Sau phản ứng (số lượng) |
1 |
1 |
1 |
1 |
Như vậy để cân bằng số nguyên tử Na và nhóm (OH), chỉ cần thêm hệ số 2 trước NaOH. Khi đó phương trình hoá học cũng đã được thiết lập:
Na2CO3 + Ba(OH)2 → BaCO3 + 2NaOH
Ta có tỉ lệ: Số phân tử Na2CO3 : Số phân tử Ba(OH)2 : Số phân tử BaCO3 : Số phân tử NaOH = 1 : 1 : 1 : 2.
Trả lời:
Phương trình hoá học: 4Fe + 3O2 → 2Fe2O3
Ta có tỉ lệ:
Số mol Fe : Số mol O2 : Số mol Fe2O3 = 4 : 3 : 2.
Từ tỉ lệ mol ta xác định được tỉ lệ khối lượng các chất:
Khối lượng Fe : Khối lượng O2 : Khối lượng Fe2O3
= (56 . 4) : (32 . 3) : (160 . 2) = 7 : 3 : 10.
Vậy cứ 7 gam Fe phản ứng hết với 3 gam O2 tạo ra 10 gam Fe2O3.
Do đó từ 5,6 gam Fe có thể tạo ra tối đa: gam gỉ sắt.
Lý thuyết KHTN 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
I. Định luật bảo toàn khối lượng
1. Nội dung định luật bảo toàn khối lượng
- Nội dung định luật: Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
- Thí nghiệm: Chuẩn bị dung dịch barium chloride, sodium sulfate, cản điện tử, cốc thuỷ tinh. Trên mặt cân đặt 2 cốc, ghi tổng khối lượng 2 cốc. Đổ cốc (1) vào cốc (2), quan sát thấy có một chất rắn màu trắng xuất hiện ở cốc (2). Đặt 2 cái trở lại cuặt cầu. So sánh tổng khối lượng của các chất trước phản ứng với tổng khối lượng các chất sau phản ứng.
- Giải thích: Trong các phản ứng hoá học, chỉ có liên kết giữa các nguyên tử thay đổi, còn số nguyên tử của mỗi nguyên tố hoá học vẫn giữ nguyên, vì vậy tổng khối lượng của các chất tham gia phản ứng bằng tổng khối lượng của các sản phẩm. Định luật này được hai nhà khoa học là Lomonosov và Lavoisier đưa ra vào thế kỉ XVIII.
2. Áp dụng định luật bảo toàn khối lượng
- Áp dụng định luật bảo toàn khối lượng:
Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride
- Biết khối lượng Barium chloride và Sodium sulfate đã phản ứng lần lượt là 20,8 gam và 14,2 gam, khối lượng của Barium sulfate tạo thành là 23,3 gam, ta sẽ xác định được khối lượng của Sodium chloride tạo thành là: 20,8 + 14,2 - 23,3 = 11,7(g).
- Tổng quát: Nếu trong phản ứng có n chất, khi biết khối lượng đã tham gia và tạo thành của (n - 1) chất, ta sẽ xác định được khối lượng của chất còn lại.
- Thành phần chính của than tổ ong là carbon. Sau khi đốt cháy than tổ ong, ta thu được xỉ than (tạp chất không cháy). Vì vậy, khối lượng của xỉ than sẽ nhẹ hơn khối lượng của than tổ ong ban đầu.
- Sau một thời gian không đậy nắp lọ đựng với sống (CaO), khối lượng của hỗn hợp sẽ tăng lên do CaO hút ẩm trong không khí tạo thành Ca(OH)2. Do đó, khối lượng của hỗn hợp sẽ tăng lên.
- Phương trình hoá học của phản ứng giữa khí hydrogen và khí oxygen là:
2H2 + O2 → 2H2O
- Trong phản ứng hoá học, tổng số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng luôn bằng tổng số nguyên tử của nguyên tố đó trong các chất sản phẩm. Sau khi cân bằng, tổng số nguyên tử của mỗi nguyên tố ở hai vẽ của sơ đồ phản ứng bằng nhau, ta được PTHH.
- Các bước lập phương trình hoá học:
Bước 1: Viết sơ đồ của phản ứng:
Al + O2 Al2O3
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố ở 2 vế. Với trường hợp này, ta cần đặt hệ số 2 trước Al2O3 và hệ số 3 trước O2:
4Al + 3O2 2Al2O3
Bước 3: Viết phương trình hoá học của phản ứng:
4Al + 3O2 2Al2O3
Lưu ý:
- Hệ số viết ngang với kí hiệu của các chất.
- Không thay đổi các chỉ số trong các công thức hoá học đã viết đúng.
- Nếu trong công thức hoá học, các chất ở 2 vế có những nhóm nguyên tử giống nhau, ta coi nhóm nguyên tử này như một "nguyên tố để cân bằng".
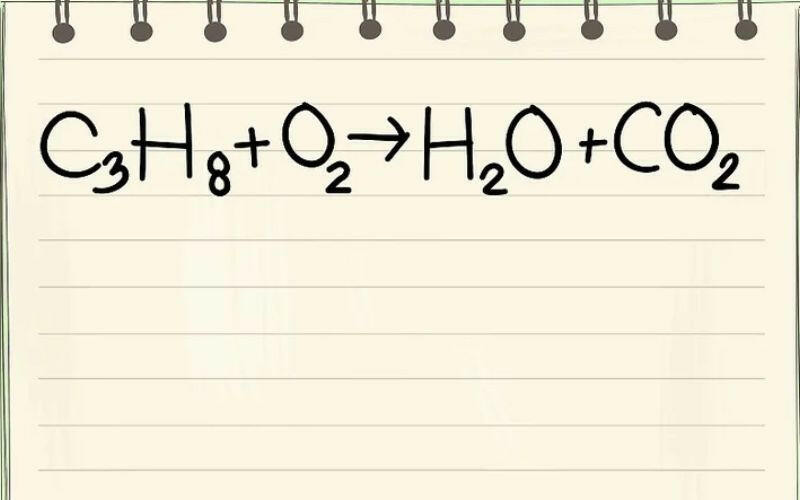
2. Ý nghĩa của phương trình hoá học
Phương trình hoá học thể hiện tỉ lệ số mol giữa các chất tham gia và sản phẩm trong một phản ứng hoá học. Từ đó, ta có thể xác định được tỉ lệ hệ số của các chất trong phản ứng và tỉ lệ số mol, cũng như tỉ lệ khối lượng của chúng. Ví dụ: Trong phản ứng 4Al + 3O2 --> 2Al2O3, ta biết được rằng để phản ứng hoàn toàn, cần sử dụng 4 mol nhôm với 3 mol oxi, tạo ra 2 mol nhôm oxit. Từ đó, ta có thể tính toán được tỉ lệ số mol và khối lượng giữa các chất trong phản ứng.
Sơ đồ tư duy KHTN 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học

Xem thêm các bài giải SGK Khoa học tự nhiên lớp 8 Kết nối tri thức hay, chi tiết khác: