Tailieumoi.vn xin giới thiệu phương trình 4Al + 3O2 → 2Al2O3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình 4Al + 3O2 → 2Al2O3
1. Phương trình phản ứng hóa học
4Al + 3O2 → 2Al2O3
2. Hiện tượng nhận biết phản ứng
- Nhôm cháy sáng tạo thành chất rắn màu trắng.
3. Điều kiện phản ứng
- Nhiệt độ cao.
4. Tính chất hoá học
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
Tác dụng với phi kim
a) Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
Tác dụng với oxit kim loại( Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
Tác dụng với nước
- Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Tác dụng với dung dịch muối
- Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
5. Cách thực hiện phản ứng
- Rắc bột nhôm trên ngọn lửa đèn cồn.
6. Bạn có biết
Tương tự Al, các kim loại khác (trừ Pt, Au, Hg) có phản ứng với khí O2 tạo oxit bazơ.
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước.
7. Bài tập liên quan
Ví dụ 1: Đốt cháy hoàn toàn m gam hỗn hợp gồm Mg và Al cần vừa đủ 5,6 lít khí O2 (đktc), thu được 18,2 gam hỗn hợp 2 oxit. Giá trị của m:
A. 9,2.
B. 6,8.
C. 10,2.
D. 12.
Hướng dẫn giải
Chọn C.
nO2=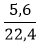
2Mg + O2 → 2MgO
4Al + 3O2 → 2Al2O3
Bảo toàn khối lượng ta có: mMg+ mAl + mO2 = mMgO + mAl2 O3
mMg + mAl+8 = 18,2
mMg + mAl = 18,2-8=10,2 gam
Vậy m = mMg+ mAl = 10,2 gam
Ví dụ 2: Đốt cháy kim loại X trong oxi thu được oxit Y. Hòa tan Y trong dung dịch HCl loãng dư, thu được dung dịch Z chứa hai muối. Kim loại X là.
A. Cu
B. Cr
C. Fe
D. Al
Hướng dẫn giải
Chọn C.
A. Quá trình phản ứng: 2Cu + O2 → MgO
CuO + 2HCl → MgCl2 + H2O
B. Quá trình phản ứng: 2Cr + 3O2 → 2Cr2O3
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
C. Quá trình phản ứng: 3Fe + 2O2 → Fe3O4
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
B. Quá trình phản ứng: 2Al + 3O2 → 2Cr2O3
Al2O3 + 6HCl → 2CrCl3 + 3H2O
Ví dụ 3: Chọn phương trình phản ứng đúng?
A. Cu + O2 → CuO2
B. 2Fe + O2 → Fe2O3
C. Zn + O2 → Zn2O
D. 2Al + 3O2 → Al2O3
Hướng dẫn giải
Chọn D.
8. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
2Al + 3H2SO4(loãng) → Al2(SO4)3 + 3H2
2Al + 6H2SO4(đặc) → Al2(SO4)3 + 3SO2↑ + 6H2O
8Al + 30HNO3(loãng) → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Al + 6HNO3(đặc, nóng) → Al(NO3)3 + 3NO2 + 3H2O