Tailieumoi.vn xin giới thiệu phương trình Al + 6HNO3(đặc, nóng) → Al(NO3)3 + 3NO2 + 3H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình Al + 6HNO3(đặc, nóng) → Al(NO3)3 + 3NO2 + 3H2O
1. Phương trình phản ứng hóa học:
Al + 6HNO3(đặc, nóng) → Al(NO3)3 + 3NO2 + 3H2O
2. Hiện tượng nhận biết phản ứng
- Phản ứng hoà tan chất rắn nhôm Al và sủi bọt khí khí màu nâu.
3. Điều kiện phản ứng
- Điều kiện nhiệt độ cao.
4. Tính chất hoá học
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
Tác dụng với phi kim
a) Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
Tác dụng với oxit kim loại( Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
Tác dụng với nước
- Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Tác dụng với dung dịch muối
- Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
5. Cách thực hiện phản ứng
- Cho Al phản ứng với dung dịch axit HNO3 đặc, nóng tạo muối nhôm sunfat và có khí màu nâu bay ra.
6. Bạn có biết
- Hầu hết các kim loại (trừ Pt, Au) đều phản ứng với axit HNO3 đặc, nóng.
- 3 kim loại Al, Cr, Fe bị thụ động hóa trong axit HNO3 đặc, nguội.
7. Bài tập liên quan
Ví dụ 1: Cân bằng phản ứng hóa học sau:
Al + HNO3(đặc, nóng) → Al(NO3)3 + NO2 + H2O
Cho biết tổng hệ số cân bằng của các chất phản ứng là bao nhiêu?
A. 5.
B. 6.
C. 7.
D. 8.
Hướng dẫn giải
Chọn C.
Al + 6HNO3(đặc, nóng) → Al(NO3)3 + 3NO2↑ + 3H2O
Ví dụ 2: Hiện tượng xảy ra khi cho Al hòa tan trong dung dịch axit HNO3(đặc) là gì?
A. Al tan và sinh khí không màu.
B. Al tan và sinh khí hóa nâu trong không khí.
C. Al tan và sinh khí màu nâu trong không khí.
D. Không có hiện tượng xảy ra.
Hướng dẫn giải
Chọn C.
Al + HNO3(đặc, nóng) → Al(NO3)3 + NO2↑ + H2O
Khí NO2 màu nâu đỏ.
Ví dụ 3: Cho m gam Al tác dụng với dung dịch HNO3 đặc dư, sinh 6,72 lít khí màu nâu đỏ. Hỏi khối lượng Al đã tác dụng?
A. 2,7 gam.
B. 5,4 gam.
C. 7,2 gam.
D. 4,5 gam.
Hướng dẫn giải
Chọn A.
Al + 6HNO3(đặc, nóng) = Al(NO3)3 + 3NO2↑ + 3H2O
nNO2=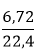
Theo phương trình phản ứng, ta có: nAl=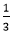
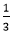
Vậy mAl=0,1.27=2,7 gam
8. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2