Tailieumoi.vn xin giới thiệu phương trình C6H5NH2 + 3Br2 → C6H2Br3NH2 + 3HBr gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Đồng . Mời các bạn đón xem:
Phương trình C6H5NH2 + 3Br2 → C6H2Br3NH2 + 3HBr
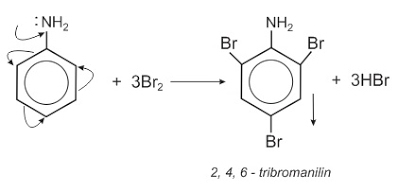
1. Phương trình phản ứng hóa học
C6H5NH2 + 3Br2 → C6H2Br3NH2 + 3HBr
2. Hiện tượng nhận biết phản ứng.
- Xuất hiện kêt tủa trắng.
3. Điều kiện phản ứng
- Nhiệt độ thường.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của C6H5NH2 (Anilin)
- Do tính chất của vòng benzen, phân tử có nhóm -NH2 nên mật độ electron của vòng benzen lớn hơn của benzen. Do đó khi thực hiện phản ứng thế, vị trí ortho và para (so với nhóm -NH2) thuận lợi, phản ứng xảy ra khá dễ dàng.
- Do tác dụng của nhóm -NH2 nên khi nhỏ vài giọt Brom vào ống đựng dung dịch anilin thấy xuất hiện kết tủa trắng. (Chú ý: Phản ứng này được dùng để nhận biết Anilin)
4.2. Bản chất của Br2 (Brom)
Brom thuộc nhóm halogen nên phản ứng với hidro để tạo thành hidro halogenua.
5. Tính chất hóa học
5.1. Tính chất hóa học của Anilin
Để lâu trong không khí, anilin chuyển sang màu đen vì bị oxi hóa bởi oxi trong không khí
Phản ứng cháy
4C6H5NH2 + 31O2 → 24CO2 + 14H2O + 2N2
Anilin phản ứng với axit mạnh tạo thành ion anilium
C6H5NH2 + HCl → C6H5NH3+Cl-
C6H5NH2+ HNO2 + HCl → C6H5N2Cl + 2H2O
5.2. Tính chất hóa học của Br2
a. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
b. Tác dụng với hidro
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
c. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
6. Cách thực hiện phản ứng
- Nhỏ vài giọt nước brom vào ống nghiệm đựng sẵn 1 ml anilin, thấy ông nghiệm xuất hiện kết tủa trắng
7. Bạn có biết
8. Bài tập liên quan
Câu 1. Phát biểu nào sau đây sai?
A. Anilin tác dụng với nước brom tạo thành kết tủa màu vàng.
B. Amino axit là hợp chất hữu cơ tạp chức.
C. Dung dịch axit glutamic làm quỳ tím chuyển màu hồng.
D. Dung dịch glyxin không làm đổi màu phenolphtalein.
Lời giải:
Đáp án: A
Giải thích:
Nhỏ vài giọt nước brom vào ống nghiệm đựng sẵn 1 ml anilin, thấy ông nghiệm xuất hiện kết tủa trắng
Câu 2. Cho các phát biểu sau:
a) Anilin tác dụng với nước brom tạo thành kết tủa trắng
b) Phản ứng giữa buta-1,3-dien với acrilonitrin là phản ứng đồng trùng hợp.
c) Thủy phân (xt, H+, to), saccarozo cũng như mantozo đều cho cùng một monosaccrit
d) Dung dịch fructozo hòa tan được Cu(OH)2.
Trong các phát biểu trên, số phát biểu không đúng là
A. 1
B. 4
C. 2
D. 3
Lời giải:
Đáp án: C
Câu 3. Hợp chất tác dụng với nước brom tạo kết tủa trắng là
A. Anđehit axetic
B. Glucozơ
C. Alanin
D. Anilin
Lời giải:
Đáp án: D
Giải thích:
Anilin C6H5NH2 + 3Br2→ C6H2Br3NH2 + 3HBr
Câu 4. Chất nào sau đây thuộc loại amin bậc một?
A. (CH3)3N.
B. CH3NHCH3.
C. CH3NH2.
D. CH3CH2NHCH3.
Lời giải:
Đáp án: C
Câu 5. Số đồng phân amin bậc một, chứa vòng benzen, có cùng công thức phân tử C7H9N là:
A. 3.
B. 5.
C. 2.
D. 4.
Lời giải:
Đáp án: D
Câu 6. Nguyên nhân gây nên tính bazơ của amin là:
A. Do phân tử amin bị phân cực mạnh.
B. Do amin tan nhiều trong H2O.
C. Do nguyên tử N có độ âm điện lớn nên cặp e chung của nguyên tử N và H bị hút về phía N.
D. Do nguyên tử N còn cặp eletron tự do nên phân tử amin có thể nhận proton.
Lời giải:
Đáp án: D
Giải thích:
Chất hoặc ion có tính bazơ nếu nó có khả năng nhận proton. (Theo thuyết bonsted)
Do nguyên tử N còn cặp eletron tự do nên phân tử amin có thể nhận proton.
Câu 7. Anilin (C4H9NH2) phản ứng với dung dịch
A. NaOH.
B. HCl.
C. Na2CO3.
D. NaCl.
Lời giải:
Đáp án: B
Giải thích:
C4H9NH2 + HCl → C4H9NH3Cl
Câu 8. Để rửa sạch lọ đã đựng anilin người ta dùng
A. dung dịch NaOH và nước.
B. dung dịch HCl và nước.
C. dung dịch amoniac và nước.
D. dung dịch NaCl và nước.
Lời giải:
Đáp án: B
Giải thích:
Anilin không tan trong nước, dễ bám vào thành lọ, cho dung dịch HCl vào anilin, phản ứng tạo muối tan trong nước → bị rửa trôi bởi nước.
C6H5NH2 + HCl → C6H5NH3Cl.
Câu 9. Hỗn hợp A gồm Alanin và axit glutamic. Cho a gam B tác dụng hoàn toàn với dd NaOH dư, thu được dung dịch C chứa (a + 30,8) gam muối. Mặt khác, nếu cho a gam A tác dụng hoàn toàn với dung dịch HCl, thu được dung dịch C chứa (a + 36,5) gam muối. Giá trị của a là?
A. 112,2 gam
B. 224,2 gam
C. 168,15 gam
D. 280,5 gam
Lời giải:
Đáp án: A
Giải thích:
Đặt nalanin = x mol; naxit glutamic = y mol
Coi phản ứng như sau ta có:
- NH2 + HCl → -NH3Cl
- COOH + NaOH → -COONa + H2O
=> nHCl = x + y = (a + 36,5 - a)/36,5 = 1 mol
nNaOH = x + 2y = (a+30,8-a)/(23 - 1) = 1,4 mol
⇒ x = 0,6 mol; y = 0,4 mol
⇒ m = 112,2 g
Câu 10. Cho 6,615 gam axit glutamic phản ứng với 100 ml dung dịch HCl 1M thu được dung dịch X. Cho 200 ml dung dịch NaOH 1M vào X được Y. Cô cạn Y thu được a gam rắn khan, biết các phản ứng xảy ra hoàn toàn. Giá trị của a là:
A. 31,310.
B. 28,890.
C. 14,845.
D. 29,690.
Lời giải:
Đáp án: C
Giải thích:
Axit glutamic có dạng: HOOC–CH2–CH2–CH(NH2)–COOH
⇒ naxit glutamic = 0,045 mol
Có nHCl= 0,1 mol; nNaOH = 0,2 mol
⇒ nNaOH dư = nNaOH ban đầu – (2nGlutamic+ nHCl) = 0,01 mol
⇒ Chất rắn khan gồm:
0,01 mol NaOH;
0,045 mol NaOOC – CH2 – CH2– CH(NH2) – COONa;
0,1 mol NaCl ⇒ m = 29,69 gam
Câu 11. Cho 0,15 mol axit Glutamic vào 175 ml dung dịch HCl 2M thu dung dịch X. Cho NaOH dư vào dung dịch X. Sau khi phản ứng xảy ra hoàn toàn, tính số mol NaOH
A. 0,65 mol
B. 0,3 mol
C. 0,6 mol
D. 0,45 mol
Lời giải:
Đáp án: A
Giải thích:
Coi hỗn hợp phản ứng với NaOH gồm H2N-C3H5-(COOH)2 và HCl
Phương trình phản ứng xảy ra
HCl + NaOH → NaCl + H2O
0,35mol 0,35 mol
H2N-C3H5-(COOH)2+ 2NaOH → H2N-C3H5(COONa)2 + 2H2O
0,15 mol 0,3 mol
Số mol nNaOH = 0,35 + 0,3 = 0,65 mol
Câu 12. Cho 13,23 gam axit glutamic phản ứng với 200 ml dung dịch HCl 1M thu được dung dịch X. Cho 400 ml dung dịch NaOH 1M vào X được Y. Cô cạn Y thu được m gam rắn khan, biết các phản ứng xảy ra hoàn toàn. Giá trị của m là:
A. 31,31.
B. 28,89.
C. 17,19.
D. 29,69.
Lời giải:
Đáp án: D
Giải thích:
Axit glutamic có dạng: HOOC–CH2–CH2–CH(NH2)–COOH
⇒ naxit glutamic = 0,09 mol
Có nHCl = 0,2 mol; nNaOH = 0,4 mol
⇒ nNaOH dư = nNaOH ban đầu– (2nGlutamic + nHCl) = 0,02 mol
⇒ Chất rắn khan gồm: 0,02 mol NaOH; 0,09 mol NaOOC–CH2–CH2 – CH(NH2)-COONa; 0,2 mol NaCl.
⇒ m = 29,69 gam
9. Một số phương trình phản ứng hoá học khác của Amin và hợp chất: