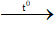Tailieumoi.vn xin giới thiệu phương trình C4H9NH2 + HCl → C4H9NH3Cl gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình C4H9NH2 + HCl → C4H9NH3Cl
1. Phản ứng hóa học:
C4H9NH2 + HCl → C4H9NH3Cl
2. Điều kiện phản ứng
- Phản ứng xảy ra ở điều kiện thường.
3. Cách thực hiện phản ứng
- Cho butylamin phản ứng với axit HCl.
4. Hiện tượng nhận biết phản ứng
- Cho hai lọ butylamin và axit HCl đặc đặt cạnh nhau thấy có khói trắng.
5. Tính chất hóa học
5.1. Tính chất hóa học của Butylamin
a. Tính bazơ :
- Dung dịch Butylamin có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein do kết hợp với proton mạnh hơn amoniac
- Amin có tính bazo yếu nên có thể phản ứng với các axit vô cơ để tạo thành muối
C4H9NH2 + HCl → C4H9NH3Cl
b. Phản ứng với axit nitrơ :
C4H9-NH2 + HONO → C4H9-OH + N2 + H2O (xúc tác HCl)
c. Phản ứng ankyl hóa :
C4H9NH2 + CH3I → C4H9-NH-CH3 + HI
d. Phản ứng với dung dịch muối của các kim loại có hiđroxit kết tủa :
3C4H9NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3C4H9NH3Cl
e. Phản ứng đốt cháy
4C4H11N + 27O2 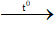
5.2. Tính chất hóa học của HCl
- Axit HCl làm đổi màu quỳ tím: Khi nhúng quỳ tím vào dung dịch axit sẽ có hiện tượng quỳ tím chuyển đỏ.
- Axit clohidric tác dụng với kim loại đứng trước H, tạo thành muối và hidro
Fe + 2HCl → FeCl2 + H2↑
- Axit clohidric tác dụng với oxit kim loại, tạo thành muối Clorua và nước
6HCl + Al2O3 →2AlCl3 + 3H2O
- Axit clohidric tác dụng với Bazơ, tạo thành muối Clorua và nước
3HCl + Al(OH)3 → AlCl3 + 3H2O
- Axit clohidric tác dụng với muối, tạo thành muối mới và axit mới
AgNO3 + 2HCl → AgCl↓ + HNO3
- Axit clohidric tác dụng với hợp chất có tính oxi hoá, thể hiện tính khử
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
Lưu ý: Axit HCl sẽ không tác dụng với những kim loại đứng sau H trong dãy điện hoá, không tác dụng với các phi kim, axit, oxit kim loại, oxit phi kim.
6. Bạn có biết
- Phản ứng trên cho thấy các amin có tính bazo.
- Các amin khác cũng có phản ứng với axit HCl tương tự butylamin.
- Người ta vận dụng tính chất này để tách riêng amin khỏi các chất hữu cơ.
7. Bài tập liên quan
Ví dụ 1: Dãy gồm các chất đều phản ứng với HCl là
A. anilin, butylamin, amoniac.
B. amoni clorua, butylamin, natri hiđroxit.
C. kali clorua, amoniac, natri hiđroxit.
D. butylamin, amoniac, natri clorua.
Hướng dẫn: anilin, butylamin, amoniac đều phản ứng với HCl.
Đáp án: A
Ví dụ 2: Có thể nhận biết lọ đựng dung dịch C4H9NH2 bằng cách nào trong các cách sau ?
A. Nhận biết bằng mùi.
B. Thêm vài giọt dung dịch Na2SO4.
C. Thêm vài giọt dung dịch Na2CO3.
D. Sử dụng quỳ tím.
Hướng dẫn: dung dịch C4H9NH2 làm quỳ tím chuyển sang màu xanh.
Đáp án: D
Ví dụ 3: Thí nghiệm nào sau thể hiện tính bazơ của butylamin?
A. Cho butylamin phản ứng với nước brom.
B. Cho butylamin phản ứng với dung dịch muối sắt.
C. Cho butylamin phản ứng với dung dịch NaOH.
D. Cho butylamin phản ứng với dung dịch HCl.
Hướng dẫn: Thí nghiệm thể hiện tính bazơ của butylamin là cho butylamin phản ứng với dung dịch HCl.
Đáp án: D
8. Một số phương trình phản ứng hoá học khác của Amin và hợp chất:
C4H9NH2 + HONO → C4H9OH + N2 + H2O
3C4H9NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3C4H9NH3Cl
4C4H11N + 27O2 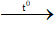
(C2H5)2NH + HCl → (C2H5)2NH2Cl
(C2H5)2NH + HONO → (C2H5)2N-N=O + H2O
C2H5NHC2H5 + CH3I