Với Giải hóa học lớp 10 trang 71 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 71 Cánh diều
Luyện tập 1 trang 71 Hóa học 10: Xác định số oxi hóa của mỗi nguyên tử nguyên tố trong các hợp chất ion Al2O3, CaF2.
Phương pháp giải:
- Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó.
- Cách xác định số oxi hóa
+ Cách 1: Dựa theo số oxi hóa của một số nguyên tử đã biết.
Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, ...) là +2, số oxi hóa của Al là +3.
Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó.
+ Cách 2: Dựa theo công thức cấu tạo.
Cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
Lời giải:
- Al2O3: Số oxi hóa của O là -2.
Gọi a là số oxi hóa của Al. Áp dụng quy tắc 1 và 2
=> a.2 + (-2).3 = 0 → x = +3
Vậy số oxi hóa của O là -2, Al là +3
- CaF2
Gọi x là số oxi hóa của F, theo quy tắc 1 và 2 có:
1.(+2) + 2.x = 0 → x = -1.
Vậy số oxi hóa của Ca là +2, của F là -1.
Luyện tập 2 trang 71 Hóa học 10: Xác định số oxi hóa của mỗi nguyên tử trong hợp chất sau: N = O, CH4.
Phương pháp giải:
- Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó.
- Cách xác định số oxi hóa
+ Cách 1: Dựa theo số oxi hóa của một số nguyên tử đã biết.
Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, ...) là +2, số oxi hóa của Al là +3.
Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó.
+ Cách 2: Dựa theo công thức cấu tạo.
Cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
Lời giải:
- N = O có công thức ion giả định là N2+O2-
Vậy số oxi hóa của N là +2, O là -2.
- CH4 có công thức ion giả định là C4-H4+
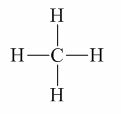
Vậy số oxi hóa của C là -4, H là +1.
Câu hỏi 1 trang 71 Hóa học 10: Dựa theo quy tắc octet, giải thích vì sao số oxi hóa của O là -2, của kim loại nhóm IA là +1, của kim loại nhóm IIA là +2 và của Al là +3.
Phương pháp giải:
Quy tắc octet: trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm.
Lời giải:
- Nguyên tử O với cấu hình electron là 1s22s22p4, có 6 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhận thêm 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của O là -2.
O + 2e → O2-
- Nguyên tử kim loại nhóm IA có cấu hình electron chung là ns1, có 1 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của kim loại nhóm IA là +1.
- Nguyên tử kim loại nhóm IIA có cấu hình electron chung là ns2, có 2 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của kim loại nhóm IIA là +2.
- Nguyên tử Al với cấu hình electron là [Ne]3s23p1, có 3 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 3 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của Al là +3.
Al → Al3+ + 3e
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: