Với Giải hóa học lớp 10 trang 56 Chân trời sáng tạo chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 56 Chân trời sáng tạo
Câu hỏi 4 trang 56 Hóa học 10: Trong các nguyên tố kim loại và phi kim, nguyên tử của những nguyên tố nào có xu hướng tạo thành cation hoặc anion? Giải thích
Phương pháp giải:
- Nguyên tố kim loại dễ nhường electron
- Nguyên tố phi kim dễ nhận electron
Lời giải:
- Các nguyên tố kim loại dễ nhường electron => Tạo thành cation
- Các nguyên tố phi kim dễ nhận electron => Tạo thành anion
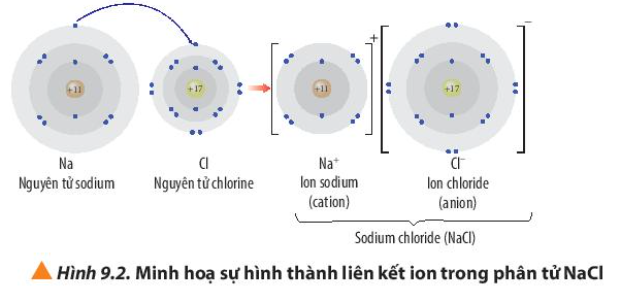
Câu hỏi 5 trang 56 Hóa học 10: Quan sát Hình 9.2, hãy trình bày sự hình thành liên kết ion trong phân tử NaCl khi sodium tác dụng với chlorine
Phương pháp giải:
- Kim loại sodium dễ dàng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm
- Phi kim chlorine dễ dàng nhận 1 electron để đạt cấu hình electron bền vững của khí hiếm
Lời giải:
- Kim loại sodium có 1 electron ở lớp ngoài cùng => Dễ dàng nhường 1 electron thành ion Na+
- Phi kim chlorine có 7 electron ở lớp ngoài cùng => Dễ dàng nhận 1 electron thành ion Cl-
=> Nguyên tử Cl sẽ nhận 1 electron của nguyên tử Na tạo thành Na+ và Cl-. 2 ion này sẽ liên kết với nhau tạo thành phân tử NaCl
Câu hỏi 6 trang 56 Hóa học 10: Các ion Na+ và Cl- có cấu hình electron nguyên tử của các khí hiếm tương ứng nào?
Phương pháp giải:
- Ion Na+ có 10 electron ở lớp vỏ và có 2 lớp electron
- Ion Cl- có 18 electron ở lớp vỏ và có 3 lớp electron
Lời giải:
- Ion Na+ có 10 electron ở lớp vỏ và có 2 lớp electron => Giống cấu hình electron của khí hiếm Ne
- Ion Cl- có 18 electron ở lớp vỏ và có 3 lớp electron => Giống cấu hình electron của khí hiếm Ar
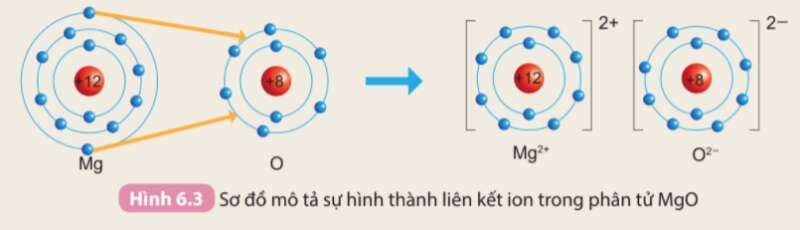
Luyện tập trang 56 Hóa học 10: Trình bày sự hình thành liên kết ion trong phân tử MgO khi magnesium tác dụng với oxygen
Phương pháp giải:
- Nguyên tử Mg có 2 electron ở lớp vỏ ngoài cùng => Có xu hướng nhường 2 electron
- Nguyên tử O có 6 electron ở lớp vỏ ngoài cùng => Có xu hướng nhận 2 electron
Lời giải:
- Nguyên tử Mg (Z = 12): 1s22s22p63s2 => Có 2 electron ở lớp ngoài cùng
=> Có xu hướng nhường 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion Mg2+
- Nguyên tử O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp ngoài cùng
=> Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2-
=> Nguyên tử O sẽ nhận 2 electron của nguyên tử Mg tạo thành 2 ion Mg2+ và O2-. 2 ion liên kết với nhau tạo thành phân tử MgO
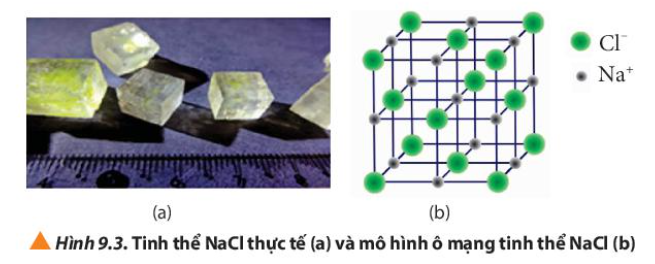
Câu hỏi 7 trang 56 Hóa học 10: Quan sát Hình 9.3, cho biết:
a) Tinh thể NaCl có cấu trúc của hình khối nào.
b) Các ion Na+ và Cl- phân bố trong tinh thể như thế nào
c) Xung quanh mỗi loại ion có bao nhiêu ion ngược dấu gần nhất
Phương pháp giải:
Quan sát Hình 9.3 và rút ra nhận xét
Lời giải:
a) Tinh thể NaCl có cấu trúc là hình lập phương
b) Các ion Na+ và Cl- được xếp xen kẽ nhau
c) Xung quanh mỗi loại ion có 6 ion ngược dấu gần nhất.
Ví dụ: xung quanh ion Na+ có 6 ion Cl-
Câu hỏi 8 trang 56 Hóa học 10: Em hiểu thế nào về tinh thể ion?
Phương pháp giải:
Tinh thể ion lớp một hợp chất ion kết tinh
Lời giải:
- Tinh thể ion là hợp chất ion
- Các ion liên kết với nhau nhờ lực hút tĩnh điện tạo thành hợp chất ion
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: