Với Giải hóa học lớp 10 trang 58 Chân trời sáng tạo chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 58 Chân trời sáng tạo
Bài 1 trang 58 Hóa học 10: Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
Phương pháp giải:
- Viết cấu hình của Mg => Cấu hình electron của Mg2+
Lời giải:
Nguyên tử Mg (Z = 12): 1s22s22p63s2
=> Mg2+: 1s22s22p6 => Ion Mg2+ có 10 electron và 2 lớp electron
=> Giống cấu hình electron của nguyên tử khí hiếm Neon
Đáp án B
Bài 2 trang 58 Hóa học 10: Cho các ion sau: Ca2+, F-, Al3+ và N3-. Số ion có cấu hình electron của khí hiếm neon là
A. 4
B. 2
C. 1
D. 3
Phương pháp giải:
- Viết cấu hình của các nguyên tử => Cấu hình của các ion
- Khí hiếm Ne có 10 electron ở lớp vỏ và 2 lớp electron
Lời giải:
- Nguyên tử Ca (Z = 20): 1s22s22p63s23p64s2 => Cấu hình Ca2+: 1s22s22p63s23p6
- Nguyên tử F (Z = 9): 1s22s22p5 => Cấu hình F-: 1s22s22p6
- Nguyên tử Al (Z = 13): 1s22s22p63s23p1 => Cấu hình Al3+: 1s22s22p6
- Nguyên tử N (Z = 7): 1s22s22p3 => Cấu hình N3-: 1s22s22p6
- Nguyên tử khí hiếm Neon có cấu hình: 1s22s22p6
=> Có 3 ion có cấu hình electron của khí hiếm Neon: F-, Al3+, N3-
Đáp án D
Bài 3 trang 58 Hóa học 10: Potassium và magnesium là các nguyên tố thiết yếu đối với cơ thể sinh vật sống.
a) Viết cấu hình electron của các ion được tạo thành từ nguyên tử của các nguyên tố này. Chúng có cấu hình electron của những nguyên tử khí hiếm nào?
b) Có hợp chất ion nào chỉ tạo bởi các ion trên với nhau không? Vì sao?
Phương pháp giải:
- Nguyên tố potassium có Z = 19 => Cấu hình electron => Ion
- Nguyên tử magnesium có Z = 12 => Cấu hình electron => Ion
Lời giải:
a)
- Nguyên tố potassium (Z = 19): 1s22s22p63s23p64s1 => Có xu hướng nhường 1 electron
=> Cấu hình: 1s22s22p63s23p6 (K+)
=> Ion K+ có 18 electron ở lớp vỏ và có 3 lớp electron
=> Giống cấu hình electron của khí hiếm Ar
- Nguyên tố magnesium (Z = 12): 1s22s22p63s2 => Có xu hướng nhường 2 electron
=> Cấu hình: 1s22s22p6 (Mg2+)
=> Ion Mg2+ có 10 electron ở lớp vỏ và có 2 lớp electron
=> Giống cấu hình electron của khí hiếm Ne
b) Hợp chất ion được tạo bởi 2 ion trái dấu nhau mà ion K+ và Mg2+ cùng mang dấu dương
=> Không có hợp chất ion nào chỉ tạo bởi 2 ion K+ và Mg2+
Bài 4 trang 58 Hóa học 10: Hoàn thành những thông tin còn thiếu trong bảng sau:
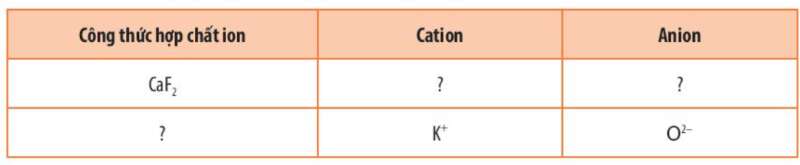
Lời giải:
|
Công thức hợp chất ion |
Cation |
Anion |
|
CaF2 |
Ca2+ |
F- |
|
K2O |
K+ |
O2- |
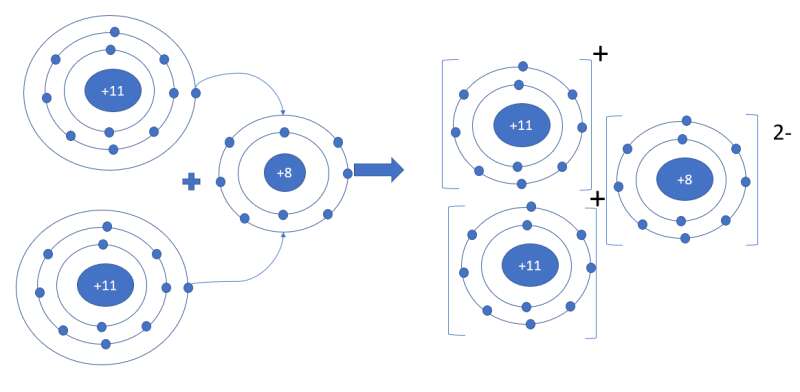
Bài 5 trang 58 Hóa học 10: Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Trình bày sự hình thành liên kết ion trong phân tử sodium oxide
Phương pháp giải:
- Viết cấu hình của nguyên tử Na => Xu hướng nhận hay nhường bao nhiêu electron
- Viết cấu hình của nguyên tử O => Xu hướng nhận hay nhường bao nhiêu electron
Lời giải:
- Nguyên tử Na (Z = 11): 1s22s22p63s1 => Xu hướng nhường 1 electron tạo thành ion Na+
- Nguyên tử O (Z = 8): 1s22s22p4 => Xu hướng nhận 2 electron tạo thành ion O2-
=> Mỗi nguyên tử Na sẽ nhường 1 electron cho nguyên tử O để tạo thành 2 ion Na+ và 1 ion O2-. 3 ion này liên kết với nhau tạo thành phân tử Na2O
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: