Với Giải hóa học lớp 10 trang 52 Chân trời sáng tạo chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 52 Chân trời sáng tạo
Mở đầu trang 52 Hóa học 10: Khi liên kết với nhau, nguyên tử của các nguyên tố dường như đã cố gắng “bắt chước” cấu hình electron nguyên tử của các nguyên tố khí hiếm để bền vững hơn. Điều này đã được nhà hóa học người Mỹ Lewis (Li-uýt, 1875 – 1946) đề nghị khi nghiên cứu về sự hình thành phân tử từ các nguyên tử. Ông gọi đó là quy tắc octet. Quy tắc octet là gì?

Lời giải:
Quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium)
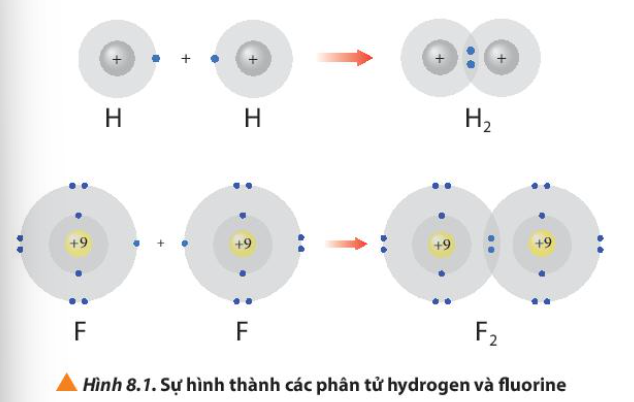
Câu hỏi 1 trang 52 Hóa học 10: Hình 8.1 giải thích sự hình thành phân tử hydrogen (H2) và fluorine (F2) từ các nguyên tử. Theo em, các nguyên tử hydrogen và fluorine đã “bắt chước” cấu hình electron của các nguyên tử khí hiếm nào khi tham gia liên kết?
Phương pháp giải:
Sau khi tham gia liên kết, nguyên tử hydrogen có 2 electron lớp ngoài cùng và nguyên tử fluorine có 8 electron lớp ngoài cùng
Lời giải:
- Sau khi tham gia liên kết:
+ Nguyên tử H: Có 1 lớp electron, 2 electron ở lớp ngoài cùng => Giống cấu hình electron của He
+ Nguyên tử F: Có 2 lớp electron, 8 electron ở lớp ngoài cùng => Giống cấu hình electron của Ne
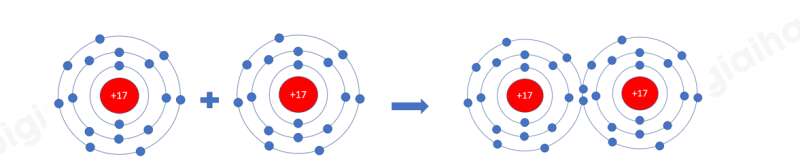
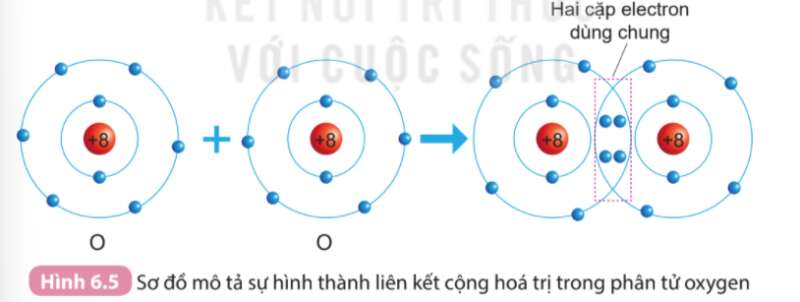
Câu hỏi 2 trang 52 Hóa học 10: Sử dụng sơ đồ tương tự như Hình 8.1, hãy giải thích sự tạo thành phân tử chlorine (Cl2) và oxygen (O2) từ các nguyên tử tương ứng
Phương pháp giải:
- Nguyên tử O có 6 electron ở lớp ngoài cùng => Cần thêm 2 electron
- Nguyên tử Cl có 7 electron ở lớp ngoài cùng => Cần thêm 1 electron
Lời giải:
- Nguyên tử chlorine có 7 electron ở lớp ngoài cùng. Khi 2 nguyên tử Cl liên kết với nhau, mỗi nguyên tử Cl sẽ góp 1 electron để tạo 1 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm
- Nguyên tử oxygen có 6 electron ở lớp ngoài cùng. Khi 2 nguyên tử O liên kết với nhau, mỗi nguyên tử O sẽ góp 2 electron để tạo 2 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: