Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 11 Bài 31: Luyện tập Anken và Ankadien chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 31: Luyện tập Anken và Ankadien
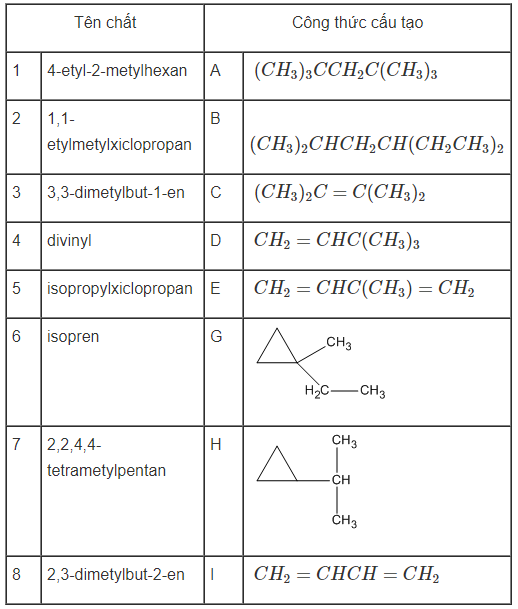
Bài 31.1 trang 47 SBT Hóa học 11: Ghép tên chất với công thức cấu tạo cho đúng.
Phương pháp giải:
Học sinh nắm vững cách gọi tên và công thức cấu tạo của chất để làm bài tập.
Lời giải:
7-A ; 1-B ; 8-C ; 3-D ; 6-E ; 2-G ; 5-H ; 4-I
Bài 31.2 trang 47 SBT Hóa học 11: Hợp chất
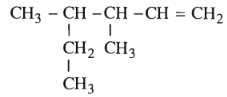 có tên là gì ?
có tên là gì ?
A. 2-etyl-3-metylpent-4-en.
B. 4-etyl-3-metylpen-1-en.
C. 3,4-đimetyl-hex-5-en.
D. 3,4-đimetyl-hex-1-en.
Lời giải:
Hợp chất trên có tên là: 3,4-đimetyl-hex-1-en.
=> Chọn D.
Bài 31.3 trang 47 SBT Hóa học 11: Hợp chất
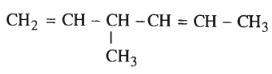 có tên là gì ?
có tên là gì ?
A. 3-metylhex-1,2-đien.
B. 4-metylhex-1,5-đien.
C. 3-metylhex-1,4-đien.
D. 3-metylhex-1,3-đien.
Lời giải:
Hợp chất trên có tên là: 3-metylhex-1,4-đien.
=> Chọn C.
Bài 31.4 trang 48 SBT Hóa học 11: Trong các chất dưới đây, chất nào là ankađien liên hợp ?
A. CH2 = CH - CH2 - CH = CH2
B. 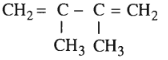
C. CH2 = CH - CH2 - CH = CH - CH3
D. CH2 = C = CH2
Lời giải: Ankađien có hai liên kết đôi cách nhau một liên kết đơn được gọi là Ankađien liên hợp.
=> Chọn B.
Bài 31.5 trang 48 SBT Hóa học 11: Cho chất 2 – metylbut – 2 – en phản ứng cộng với nước, sản phẩm chủ yếu thu được sẽ là:
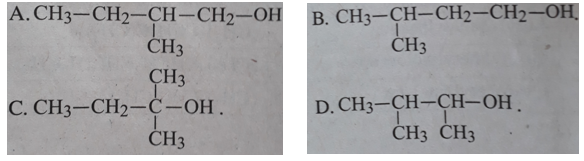
Phương pháp giải: Áp dụng qui tắc Mac – cop –nhi – côp:
Lời giải: Phản ứng cộng HA vào anken không đối xứng tuân theo Quy tắc Mac – cop –nhi – côp: “ nguyên tử H ưu tiên cộng vào nguyên tử cacbon bậc thấp hơn ở nối kép , A ưu tiên cộng vào nguyên tử cacbon bậc cao hơn”
=> Chọn C.
Bài 31.6 trang 48 SBT Hóa học 11: Cho đivinyl phản ứng cộng với HBr theo tỉ lệ mol 1:1 ở 400C thì sản phẩm chính thu được là:
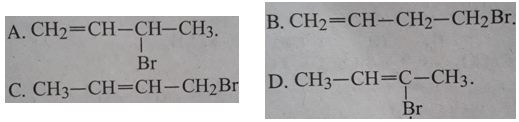
Lời giải: Khi đivinyl (butan – 1, 3 – đien) phản ứng cộng với brom theo tỉ lệ 1:1 (về số mol) ở 400C trong sản phẩm chính brom được cộng vào vị trí cacbon 1,4.
=> Chọn C.
Bài 31.7 trang 49 SBT Hóa học 11: Hỗn hợp khí A chứa nitơ và hai hiđrocacbon kế tiếp nhau trong một dãy đồng đẳng. Khối lượng hỗn hợp A là 18,3 g và thể tích của nó là 11,2 lít. Trộn A với một lượng dư oxi rồi đốt cháy, thu được 11,7 gam và 21,28 lít CO2. Các thể tích đo ở đktc.
Hãy xác định công thức phân tử và phần trăm về khối lượng của từng hiđrocacbon trong hỗn hợp A.
Phương pháp giải:
+) Tính số mol nitơ và số mol hai hiđrocacbon.
+) Đặt lượng CxHy là a mol, lượng Cx+1Hy+2 là b mol
+) Khai thác dữ kiện đề bài tìm các giá trị x, y, a, b=> công thức phân tử và phần trăm về khối lượng của từng hiđrocacbon.
Lời giải:
Số mol
Khối lượng C trong A là : 0,95.12 = 11,4 (g).
Số mol
Khối lượng H trong A là : 0,65.2 = 1,3 (g).
Tổng khối lượng của C và H chính là tổng khối lượng 2 hiđrocacbon. Vậy, khối lượng N2 trong hỗn hợp A là : 18,30 - (11,4 + 1,3) = 5,6 (g)
Số mol
Số mol 2 hidrocacbon =
Đặt lượng CxHy là a mol, lượng Cx+1Hy+2 là b mol :
a + b = 0,2 (1)
Số mol C = số mol CO2, do đó :
xa + (x + 1)b = 0,95 (2)
Số mol H = 2. số mol , do đó :
ya + (y+ 2)b = 2.0,65= 1,3
Từ (2) ta có x(a + b) + b = 0,95 b = 0,95 - 0,3x
Vì 0 < b < 0,3, nên 0 < 0,95 - 0,3x < 0,3
Từ đó tìm được 2,16 < x < 3,16 x = 3.
Thay giá trị tìm được của a và b vào (3), ta có y = 4.
% về khối lượng của C3H4 trong hỗn hợp A : . 100% = 54,6%
% về khối lượng của C4H6 trong hỗn hợp A : . 100% = 14,7%