Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 11 Bài 41: Phenol chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Phenol lớp 11.
Giải bài tập Hóa học lớp 11 Bài 41: Phenol
Câu hỏi và bài tập( trang 193 SGK Hóa học 11)
Bài 1 trang 193 SGK Hóa học 11: Ghi Đ (đúng) hoặc S (sai) vào ô trống bên cạnh các câu sau:
a) Phenol C6H5-OH là một rượu thơm
b) Phenol tác dụng được với natri hiđroxit tạo thành muối và nước.
c) Phenol tham gia phản ứng thế brom và thế nitro dễ hơn benzen
d) Dung dịch phenol làm quỳ tím hóa đỏ do nó là axit
e) Giữa nhóm –OH và vòng benzen trong phân tử phenol có ảnh hưởng qua lại lẫn nhau.
Lời giải :
a) S vì rượu thơm là rượu có vòng benzen và nhóm -OH phải gắn vào cacbon no, chứ không gắn trực tiếp vào vòng benzen
b) Đ PTHH: 2C6H5OH + 2NaOH 2C6H5ONa + H2O
c) Đ
d) S vì phenol có tính axit rất yếu nên không làm quỳ tím chuyển sang màu đỏ
e) Đ
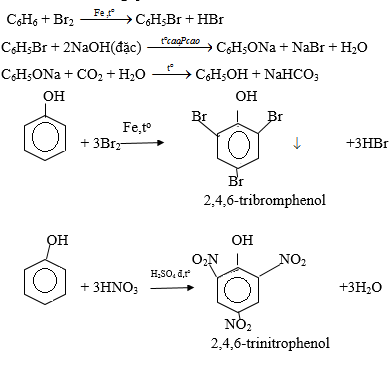
Bài 2 trang 193 SGK Hóa học 11: Từ benzen và các chất vô cơ cần thiết có thể điều chế được các chất sau:
2,4,6-tribomphenol (1); 2,4,6-trinitrophenol (2).
Viết phương trình hóa học của các phản ứng xảy ra.
Phương pháp giải:
Có thể điều chế theo sơ đồ:
Lời giải :
Bài 3 trang 193 SGK Hóa học 11: Cho 14,0 gam hỗn hợp A gồm phenol và etanol tác dụng với natri dư thu được 2,24 lít khí hidro (đktc)
a) Viết các phương trình hóa học xảy ra.
b) Tính thành phần phần trăm khối lượng của mỗi chất trong A.
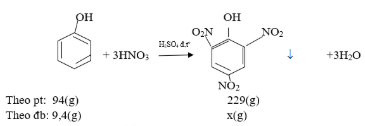
c) Cho 14,0 gam hỗn hợp A tác dụng với HNO3 thì thu được bao nhiêu gam axit picric (2,4,6- trinitrophenol)?
Phương pháp giải :
a) 2C6H5OH + 2Na → 2C6H5ONa + H2↑
2 C2H5OH + 2Na → 2C2H5OH + H2↑
b) Đổi số mol H2
Gọi x và y lần lượt là số mol của C6H5OH và của C2H5OH
Ta có hệ phương trình:
c) Chỉ có phenol tác dụng với HNO3 tạo ra axit picric (2,4,6- trinitrophenol)
Viết PTHH, tính số mol axit picric theo số mol của phenol
C6H5OH + 3HNO3 → (NO2)3C6H2OH + 3H2O
Lời giải:
Gọi x và y lần lượt là số mol của C6H5OH và của C2H5OH
a) 2C6H5OH + 2Na → 2C6H5ONa + H2↑
x mol mol
2 C2H5OH + 2Na → 2C2H5OH + H2↑
y mol
b) =>
c)
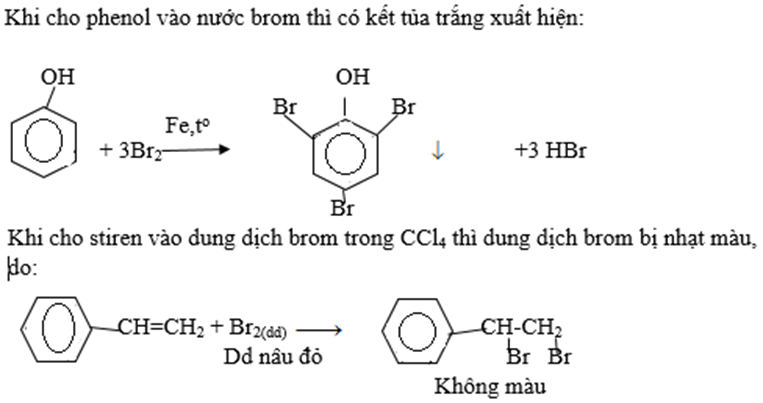
Bài 4 trang 193 SGK Hóa học 11: Cho từ từ phenol vào nước brom (1) ; stiren vào dung dịch brom trong CCl4 (2). Nêu hiện tượng và viết các phương trình hóa học.
Lời giải:
Bài 5 trang 193 SGK Hóa học 11: Sục khí CO2 vào dung dịch natri phenolat thấy dung dịch vẩn đục , trong dung dịch có NaHCO3 được tạo thành. Viết phương trình hóa học của phản ứng xảy ra và giải thích. Nhận xét về tính axit của phenol.
Phương pháp giải :
phenol là dd có tính axit yếu hơn axit cacbonic nên bị axit cacbonic đẩy ra khỏi dung dịch muối
Lời giải :
Phenol là axit yếu nên bị axit cacbonic đẩy ra khỏi dung dịch muối:
C6H5ONa + H2O + CO2→ C6H5OH + NaHCO3
Dung dịch vẩn đục vì có C6H5OH sinh ra
Bài 6 trang 193 SGK Hóa học 11: Viết các phương trình hóa học điều chế: phenol từ benzen (1); stiren từ etylbenzen (2). Các chất vô cơ cần thiết coi như có đủ.
Phương pháp giải:
Có thể viết phương trình điều chế theo sơ đồ sau:
C6H6 C6H5Br C6H5ONa C6H5OH
CH3CH2- C6H5 CH3CHBr- C6H5 CH2=CH-C6H5
Lời giải :
- Điều chế phenol từ benzen
C6H6 + Br2 C6H5Br + HBr
C6H5Br + 2NaOH đặc C6H5ONa + NaBr +
C6H5ONa + HCl → C6H5OH + NaCl
- Điều chế etylbenzen từ stiren
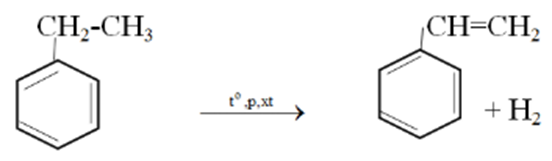
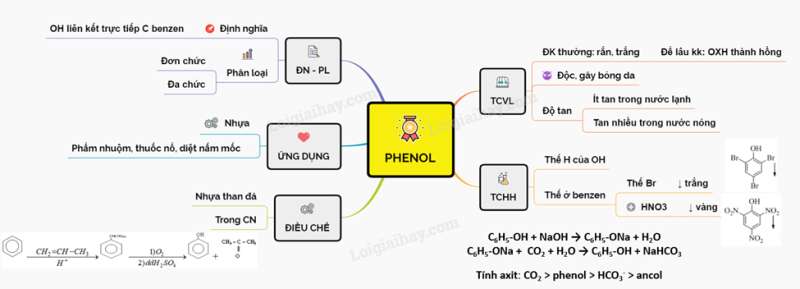
I. ĐỊNH NGHĨA, PHÂN LOẠI
1. Định nghĩa
- Phenol là những hợp chất hữu cơ trong phân tử có nhóm -OH liên kết trực tiếp với nguyên tử C của vòng benzen
Lưu ý: Cần phân biệt phenol và ancol thơm
2. Phân loại
Dựa vào số nhóm -OH trong phân tử, phenol chia thành 2 loại: phenol đơn chức và đa chức
II. TÍNH CHẤT VẬT LÍ
- Ở điều kiện thường, phenol là chất rắn màu trắng, nóng chảy ở 43 độ C. Để lâu, phenol bị oxi hóa chậm bởi không khí nên chuyển thành màu hồng
- Phenol rất độc, khi dây vào tay có thể gây bỏng da
- Phenol ít tan trong nước lạnh, nhưng tan nhiều trong nước nóng ( tan tốt nhất ở 66 độ C) và etanol
III. TÍNH CHẤT HÓA HỌC
1. Phản ứng thế nguyên tử H của nhóm –OH
Tác dụng với kim loại kiềm và dung dịch kiềm tạo muối phenolat:
C6H5-OH + NaOH → C6H5-ONa + H2O
C6H5-ONa + CO2 + H2O → C6H5-OH + NaHCO3
So sánh tính axit: CO2 > phenol > HCO3- > ancol.
2. Phản ứng ở vòng benzen
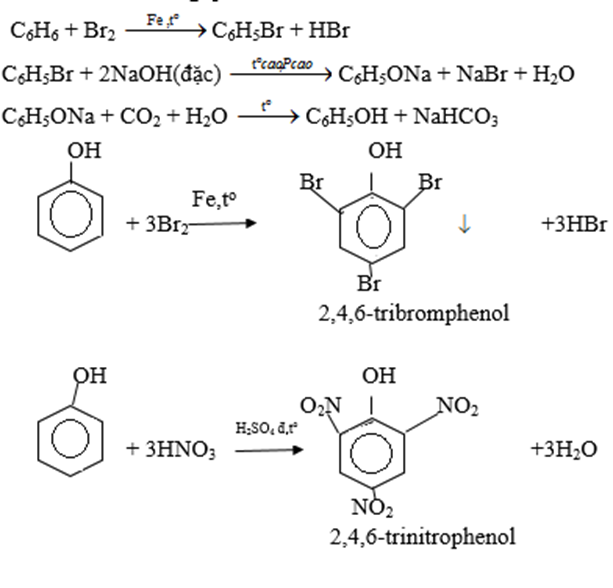
- Phenol tác dụng với nước brom tạo kết tủa trắng.
- Phản ứng thế vào nhân thơm ở phenol dễ hơn benzen nếu cho phenol phản ứng ở điều kiện êm dịu hơn thì thế được ở các vị trí para và ortho
Ví dụ: Dung dịch phenol tác dụng với dung dịch HNO3 cho 2,4,6-trinitrophenol kết tủa màu vàng
 + HNO3 →
+ HNO3 →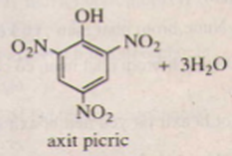
IV. ỨNG DỤNG
- Phenol là nguyên liệu dùng để sản xuất các loại nhựa dùng để chế tạo các đồ dùng dân dụng
- Phenol còn được dùng để sản xuất phẩm nhuộm, thuốc nổ, chất diệt nấm mốc,...
V. ĐIỀU CHẾ
- Từ nhựa than đá:
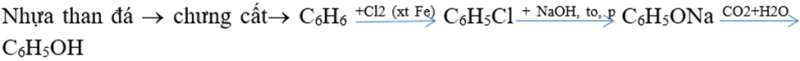
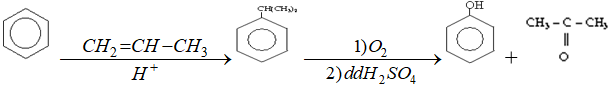
- Trong công nghiệp điều chế đồng thời phenol và xeton như sau:
Sơ đồ tư duy: Phenol