Với tóm tắt lý thuyết Hóa học lớp 9 Chương 4 có đáp án: Hiđrocacbon. Nhiên liệu hay, chi tiết cùng với 300 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 9.
Hóa học 9 Chương 4: Hiđrocacbon. Nhiên liệu
Trắc nghiệm Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
Bài 1: Các chất thuộc loại hiđrocacbon là
A. CH4, C2H6, CCl4
B. C2H6O, C2H4O2
C. HCHO, CaC2, C4H8
D. CH4, C2H6, C6H6
Lời giải
Các chất thuộc loại hiđrocacbon là các chất chỉ chứa C và H: CH4, C2H6, C6H6
Đáp án: D
Bài 2: Công thức cấu tạo cho biết:
A. tỉ lệ số nguyên tử giữa các nguyên tố
B. thành phần của mỗi nguyên tố trong phân tử
C. số lượng nguyên tố trong mỗi nguyên tử
D. thành phần của nguyên tử và trật tự liên kết giữa các nguyên tử trong phân tử
Lời giải
Công thức cấu tạo cho biết: thành phần của nguyên tử và trật tự liên kết giữa các nguyên tử trong phân tử
Đáp án: D
Bài 3: Số công thức cấu tạo của C4H10 là
A. 1 B. 3
C. 2 D. 4
Lời giải
có ∆ = 0 => HCHC no, mạch hở
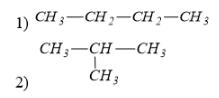
Đáp án: C
Bài 4: Số công thức cấu tạo mạch hở có thể có của C4H8 là
A. 3 B. 4
C. 5 D. 6
Lời giải
có ∆ = 1 => π = 1 (vì v = 0) => trong phân tử có 1 liên kết đôi
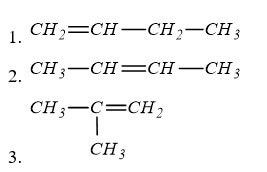
Đáp án A
Bài 5: Chọn Bài đúng trong các Bài sau:
A. Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất có trong tự nhiên.
B. Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất của cacbon.
C. Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất hữu cơ.
D. Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các chất trong cơ thể sống.
Lời giải
Bài đúng là: Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất hữu cơ
Đáp án: C
Bài 6: Dựa vào dữ kiện nào trong các dữ kiện sau đây để có thể nói một chất là vô cơ hay hữu cơ?
A. Trạng thái (rắn, lỏng, khí).
B. Màu sắc.
C. Độ tan trong nước.
D. Thành phần nguyên tố.
Lời giải
Dựa vào thành phần nguyên tố (trường hợp d) để xác định một hợp chất là vô cơ hay hữu cơ.
Đáp án: D
Bài 7: Chất hữu cơ là:
A. hợp chất khó tan trong nước.
B. hợp chất của cacbon và một số nguyên tố khác trừ N, Cl, O
C. hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat, muối cacbua và xianua.
D. hợp chất có nhiệt độ sôi cao.
Lời giải
Chất hữu cơ là: hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat, muối cacbua và xianua.
Đáp án: C
Bài 8: Dãy các chất sau là hiđrocacbon:
A. CH4, C2H2, C2H5Cl
B. C6H6, C3H4, HCHO
C. C2H2, C2H5OH, C6H12
D. C3H8, C3H4, C3H6
Lời giải
Dãy các chất sau là hiđrocacbon là: C3H8, C3H4, C3H6
Đáp án: D
Bài 9: Trong phân tử hợp chất hữu cơ cacbon, hiđro, oxi có hoá trị lần lượt là:
A. 2,1,2
B. 4,1,2
C. 6,1,2
D. 4,2,2
Lời giải
Trong phân tử hợp chất hữu cơ cacbon, hiđro, oxi có hoá trị lần lượt là: 4,1,2
Đáp án: B
Bài 10: Hợp chất hữu cơ nào sau đây chỉ gồm liên kết đơn?
A. C3H8; C2H2.
B. C3H8; C4H10
C. C4H10; C2H2
D. C4H10; C6H6(benzen)
Lời giải
Hợp chất hữu cơ chỉ gồm liên kết đơn là C3H8; C4H10
Đáp án: B
Bài 11: Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố
A. cacbon
B. hiđro
C. oxi
D. nitơ.
Đáp án: A
Bài 12: Chất nào sau đây không thuộc loại chất hữu cơ ?
A. CH3Cl
B. CH4
C. CO
D. CH3COONa.
Đáp án: C
Bài 13: Dãy các hợp chất nào sau đây là hợp chất hữu cơ ?
A. CH4, C2H6, CO.
B. C6H6, CH4, C2H5OH.
C. CH4, C2H2, CO2.
D. C2H2, C2H6O, BaCO3.
Đáp án: B
Bài 14: Dãy các chất nào sau đây đều là hiđrocacbon ?
A. C2H6, C4H10, CH4.
B. CH4, C2H2, C3H7Cl.
C. C2H4, CH4, C2H5Br.
D. C2H6O, C3H8, C2H2.
Đáp án: A
Bài 15: Dãy các chất nào sau đây đều là dẫn xuất của hiđrocacbon ?
A. C2H6O, C2H4, C2H2.
B. C2H4, C3H7Cl, CH4O.
C. C2H6O, C3H7Cl, C2H5Br.
D. C2H6O, C3H8, C2H2.
Đáp án: C
Bài 16: Trong các chất sau: CH4, CO, C2H6, K2CO3, C2H5ONa có
A. 1 hợp chất hữu cơ và 4 hợp chất vô cơ.
B. 2 hợp chất hữu cơ và 3 hợp chất vô cơ.
C. 4 hợp chất hữu cơ và 1 hợp chất vơ cơ.
D. 3 hợp chất hữu cơ và 2 hợp chất vô cơ.
Đáp án: D
3 hợp chất hữu cơ: CH4; C2H6; C2H5ONa.
2 hợp chất vô cơ: CO; K2CO3.
Bài 17: Thành phần phần trăm về khối lượng của nguyên tố C trong C2H6O là
A. 52,2%.
B. 55,2%.
C. 13,0%.
D. 34,8%.
Đáp án: A
Bài 18: Chọn Bài đúng trong các Bài sau:
A. Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất có trong tự nhiên.
B. Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon.
C. Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu về các hợp chất hữu cơ.
D. Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các chất trong cơ thể sống.
Đáp án: C
Bài 19: Phân tử chất hữu cơ X có 2 nguyên tố C, H. Tỉ khối hơi của X so với hiđro là 21. Công thức phân tử của X là
A. C4H8
B. C3H8
C. C3H6
D. C6H6
Đáp án: C
MX = 21.MH2 = 21.2 = 42 (g/mol)
Vậy X là C3H6.
Bài 20: Nhận xét nào sau đây không đúng?
A. Hợp chất hữu cơ có ở xung quanh ta.
B. Hợp chất hữu cơ là hợp chất của cacbon.
C. Khi đốt cháy các hợp chất hữu cơ đều thấy tạo ra CO2.
D. Đốt cháy hợp chất hữu cơ luôn thu được CO2 và H2O.
Đáp án: D.
Trắc nghiệm Bài 35: Cấu tạo phân tử hợp chất hữu cơ
Bài 1: Hiđrocacbon X có 83,33% khối lượng Cacbon. Số đồng phân cấu tạo của X là:
A. 4 B. 3
C. 2 D. 1
Lời giải
X là hiđrocacbon => X chỉ chứa C và H
Gọi CTPT của X có dạng CxHy (y ≤ 2x + 2)
=> %mH = 100% - %mC = 100% - 83,33% = 16,67%
=> x : y = ![]()
=> CTPT của X có dạng: (C5H12)n hay C5nH12n
Vì y ≤ 2x + 2 => 12n ≤ 5n + 7 => n ≤ 1 => n = 1
=> CTPT của X là C5H12
Ta có: ∆ = ![]() = 0 => C5H12 là hiđrocacbon no, mạch hở
= 0 => C5H12 là hiđrocacbon no, mạch hở
Các CTCT của X là:

Đáp án: B
Bài 2: Phân tử hợp chất hữu cơ A có 2 nguyên tố. Đốt cháy hoàn toàn 3 gam chất A thu được 5,4 gam nước. Biết khối lượng mol của A là 30 gam. Công thức phân tử của A là
A. C2H6 B. C3H8
C. C2H4 D. CH3
Lời giải
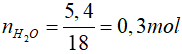
Hợp chất hữu có A có 2 nguyên tố, khi đốt cháy thu được nước => A chứa C và H
nH = 2.nH2O = 0,6 mol
Vì A chỉ chứa C và H => mA = mC + mH = 3 - 0,6 = 2,4 gam
=> nC = 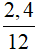 = 0,2 mol
= 0,2 mol
=> nC : nH = 0,2 : 0,6 = 1 : 3
=> Công thức đơn giản nhất của A là (CH3)n
M = 30 => n = 2
=> CTPT của A là C2H6
Đáp án: A
Bài 3: Vitamin A là một chất dinh dưỡng thiết yếu cho con người. Trong thực phẩm, vitamin A tồn tại ở dạng chính là retinol (chứa C, H, O) trong đó thành phần % khối lượng H và O tương ứng là 10,49% và 5,594%. Biết CTPT của retinol là:
A. C18H30O
B. C22H26O
C. C21H18O
D. C20H30O
Lời giải
Vì A chỉ chứa C, H và O
=> %mC = 100% - %mH - %mO = 100% - 10,49% - 5,594% = 83,916%
=> x : y : z = 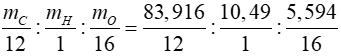
= 6,993 : 10,49 : 0,349 = 20 : 30 : 1
Vì renitol chứa một nguyên tử O => z = 1
=> x = 20 và y = 30
=> CTPT của retinol là C20H30O
Đáp án: D
Bài 4: Một hợp chất hữu cơ Y khi đốt cháy hoàn toàn thu được CO2 và H2O có số mol bằng nhau. Đồng thời số mol oxi tối thiểu cần dùng bằng 4 lần số mol của Y. Biết trong Y chỉ chứa 1 nguyên tử O. Công thức phân tử của Y là
A. C2H6O
B. C4H8O
C. C3H6O
D. C3H8O.
Lời giải
Gọi CTPT của Y có dạng CxHyO
Vì đầu bài chỉ cho các tỉ lệ, không cho số mol cụ thể => giả sử đốt cháy 1 mol Y
CxHyO + ![]() O2
O2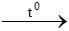 xCO2 +
xCO2 + 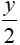 H2O
H2O
1 mol →![]() mol → x mol →
mol → x mol →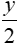 mol
mol
Phản ứng thu được số mol CO2 và H2O bằng nhau => x =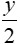 (1)
(1)
Số mol oxi cần dùng bằng 4 lần số mol của Y =>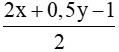 =4 (2)
=4 (2)
Thay (1) vào (2) ta có: 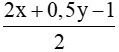 = 4 => 1,5y – 1 = 8 => y = 6
= 4 => 1,5y – 1 = 8 => y = 6
Thay y = 6 vào (1) => x = 3
=> CTPT của Y là C3H6O
Đáp án: C
Bài 5: Đốt cháy hoàn toàn 0,42 gam hợp chất hữu cơ X rồi dẫn toàn bộ sản phẩm cháy (chỉ gồm CO2 và H2O) lần lượt qua bình (1) đựng H2SO4 đặc dư, bình (2) đựng dung dịch KOH dư. Kết thúc thí nghiệm thấy khối lượng bình (1) và bình (2) tăng lần lượt là 0,54 gam và 1,32 gam. Biết rằng 0,42 gam X chiếm thể tích hơi bằng thể tích của 0,192 gam O2 ở cùng điều kiện nhiệt độ và áp suất. Công thức phân tử của X là
A. C5H10O
B. C5H10
C. C4H6O
D. C3H2O2.
Lời giải
Cho hỗn hợp sản phẩm qua bình (1) đựng H2SO4 đặc, dư => H2O bị giữ lại
=>mH2O = 0,54 gam => nH2O = 0,03 mol => nH (trong X) = 2.nH2O = 0,06
Cho qua bình (2) đựng KOH dư => CO2 bị giữ lại
=>mCO2 = 1,32 gam => nCO2 = 0,03 mol => nC = nCO2 = 0,03
Vì đốt cháy X chỉ thu được CO2 và H2O => X gồm C, H và có thể có O
Ta có: mC + mH = 0,03.12 + 0,06 = 0,42 = mX
=> trong X không chứa O
=> nC : nH = 0,03 : 0,06 = 1 : 2
=> CTĐGN của X là CH2 => CTPT của X có dạng (CH2)n
0,42 gam X chiếm thể tích hơi bằng thể tích của 0,192 gam O2
=> nX = 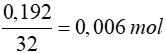
=> MX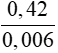 = 70 => 14n = 70 => n = 5
= 70 => 14n = 70 => n = 5
=> CTPT X là C5H10
Đáp án: B
Bài 6: Có bao nhiêu CTPT hợp chất hữu cơ X (chứa C, H, O) có tỉ khối hơi so với H2 bằng 30?
A. 1 B. 3
C. 2 D. 4
Lời giải
Tỉ khối hơi so với H2 bằng 30 => M = 30.2 = 60
Gọi CTPT của X có dạng CxHyOz
=> M = 12x + y + 16z = 60 (1)
=> 16z < 60 => z < 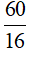 < 3,75
< 3,75
TH1: z = 1, thay vào (1) => 12x + y = 44 (2)
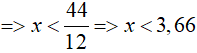
+) x = 1, thay vào (2) => y = 44 – 12 = 32 (loại)
+) x = 2, thay vào (2) => y = 44 – 12.2 = 20 (loại)
+) x = 3, thay vào (2) => y = 8 (thỏa mãn X là C3H8O)
TH2: z = 2, thay vào (1) => 12x + y = 28 (3)
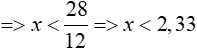
+) x = 1 => y = 28 – 12 = 16 (loại)
+) x = 2 => y = 28 – 12.2 = 4 (thỏa mãn X là C2H4O2)
TH3: z = 3, thay vào (1) => 12x + y = 12 => loại vì x và y đều ≥ 1
Vậy có 2 CTPT thỏa mãn đầu bài
Đáp án: C
Bài 7: Axit axetic có công thức là C2H4O2. Phần trăm nguyên tố C trong phân tử axit axetic là
A. 30%. B. 40%.
C. 50%. D. 60%
Lời giải
Khối lượng mol của C2H4O2 là:
MC2H4O2 = 12.2 + 4 + 16.2 = 60
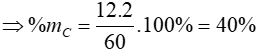
Đáp án: B
Bài 8: Công thức đơn giản nhất của hợp chất hữu cơ A là CH2Cl. Biết MA = 99. CTPT của A là
A. CH2Cl2
B. C2H4Cl2
C. CHCl3
D. C2H2Cl3
Lời giải
+) CTĐGN là CH2Cl => CTPT: (CH2Cl)n
+) Vì MA = 99 => (12 + 2 + 35,5).n = 99 => n = 2
=> CTPT: C2H4Cl2
Đáp án: B
Bài 9: Hợp chất hữu cơ A gồm 3 nguyên tố C, H, O trong đó %mC = 48,65% và %mH = 8,11%. Biết khối lượng mol phân tử của A là 74. Xác định CTPT của A
A. C2H4O2
B. C2H4O
C. C3H6O
D. C3H6O2
Lời giải
Gọi công thức đơn giản nhất là CxHyOz
%mO = 100% - %mC - %mH = 43,24%
Ta có:
![]()
=> x : y : z = 1,5 : 3 : 1 = 3 : 6 : 2
=> CTĐGN của A là C3H6O2
=> CTPT của A dạng (C3H6O2)n
MA = 74 = (12.3 + 6 + 16.2).n => n = 1
=> CTPT: C3H6O2
Đáp án: D
Bài 10: Một hợp chất X chứa 3 nguyên tố C, H, O có tỉ lệ khối lượng mC : mH : mO = 21 : 2 : 4. Hợp chất X có công thức đơn giản nhất trùng với CTPT. CTPT X là:
A. C7H8O
B. C8H10O
C. C6H6O2
D. C7H8O2.
Lời giải
Gọi CTPT của X là CxHyOz
![]()
=> CTPT của X là C7H8O (vì CTPT trùng với CTĐGN)
Đáp án: A
Bài 11: Trong các hợp chất hữu cơ, cacbon luôn có hoá trị là
A. I.
B. IV.
C. III.
D. II.
Đáp án: B
Bài 12: Nguyên tử cacbon có thể liên kết trực tiếp với nhau tạo thành các dạng mạch cacbon là
A. mạch vòng.
B. mạch thẳng, mạch nhánh.
C. mạch vòng, mạch thẳng, mạch nhánh.
D. mạch nhánh.
Đáp án: C
Bài 13: Công thức cấu tạo dưới đây là của hợp chất nào?
A. C2H4Br
B. CH3Br
C. C2H5Br2
D. C2H5Br
Đáp án: D
Bài 14: Công thức cấu tạo của một hợp chất cho biết
A. thành phần phân tử.
B. trật tự liên kết giữa các nguyên tử trong phân tử.
C. thành phần phân tử và trật tự liên kết giữa các nguyên tử trong phân tử.
D. thành phần phân tử và sự tham gia liên kết với các hợp chất khác.
Đáp án: C
Bài 15: Số liên kết đơn trong phân tử C4H10 là
A. 10.
B. 13.
C. 14.
D. 12.
Đáp án: B
Liên kết trong phân tử C4H10 có thể biểu diễn như sau:
Vậy có 13 liên kết đơn trong phân tử C4H10.
Bài 16: Một hợp chất hữu cơ có công thức C3H7Cl , có số công thức cấu tạo là
A. 4.
B. 3.
C. 1.
D. 2.
Đáp án: D
Có hai công thức cấu tạo là:
Bài 17: Có các công thức cấu tạo sau:
Các công thức cấu tạo trên biểu diễn mấy chất ?
A. 3 chất.
B. 2 chất.
C. 1 chất.
D. 4 chất.
Đáp án: C
Các công thức trên đều biểu diễn chất có công thức phân tử C5H12 mạch không nhánh.
Bài 18: Rượu etylic có công thức là
A. CH3OH
B. C2H5OH
C. CH3ONa
D. C2H5ONa
Đáp án: B
Bài 19: Phân tử chất hữu cơ X có 2 nguyên tố C, H. Tỉ khối hơi của X so với hiđro là 22. Công thức phân tử của X là
A. C4H8
B. C3H8
C. C3H6
D. C6H6
Đáp án: B
MX = 21.MH2 = 21.2 = 44 (g/mol)
Vậy X là C3H8.
Bài 20: Nhận xét nào sau đây không đúng?
A. Hợp chất hữu cơ là hợp chất của cacbon.
B. Trong các hợp chất hữu cơ, cacbon luôn có hóa trị IV.
C. Mỗi hợp chất hữu cơ có một trật tự liên kết giữa các nguyên tử trong phân tử.
D. Trong hợp chất hữu cơ, oxi có hóa trị I hoặc II.
Đáp án: D.
Trắc nghiệm Bài 36: Metan
Bài 1: Những phát biểu nào sau đây không đúng?
1) Metan tác dụng với clo khi có ánh sáng.
2) Metan là chất khí, không màu, không mùi, nặng hơn không khí.
3) Metan cháy tỏa nhiều nhiệt nên được dùng làm nhiên liệu trong đời sống và trong sản xuất.
4) Hỗn hợp giữa metan và clo là hỗn hợp nổ.
5) Trong phân tử metan có bốn liên kết đơn C-H.
6) Metan tác dụng với clo ở điều kiện thường.
A. 1, 3, 5. B. 1, 2, 6.
C. 2, 4, 6. D. 2, 4, 5
Lời giải
Các phát biểu không đúng: 2, 4, 6
2) Metan là chất khí, không màu, không mùi, nặng hơn không khí => Sai, khí metan nhẹ hơn không khí.
4) Hỗn hợp giữa Metan và Clo là hỗn hợp nổ => Sai.
6) Metan tác dụng với Clo ở điều kiện thường => Sai, phải có chiếu sáng thì phản ứng mới xảy ra
Đáp án: C
Bài 2: Đốt cháy hoàn toàn 11,2 lít khí metan. Biết các thể tích khí đo ở điều kiện tiêu chuẩn.Thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành lần lượt là
A. 22,4 lít và 22,4 lít.
B. 11,2 lít và 22,4 lít.
C. 22,4 lít và 11,2 lít.
D. 11,2 lít và 22,4 lít.
Lời giải
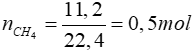
CH4 + 2O2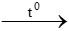 CO2 + 2H2O
CO2 + 2H2O
0,5 → 1 → 0,5 mol
⇒VO2 = 1.22,4 = 22,4 lít
VCO2 = 0,5.22,4 = 11,2 lít
Đáp án: C
Bài 3: Đốt cháy hoàn toàn 3,36 lít khí metan (đktc). Lấy sản phẩm thu được hấp thụ hoàn toàn vào nước vôi trong dư thấy xuất hiện m gam kết tủa. Giá trị của m là
A. 9 B. 10
C. 12 D. 15
Lời giải
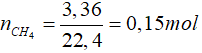
CH4 + 2O2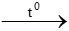 CO2 + 2H2O
CO2 + 2H2O
0,15 → 0,15 mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,15 mol → 0,15 mol
mCaCO3 = 0,15.100 = 15 gam
Đáp án: D
Bài 4: Cho 2,24 lít khí metan (đktc) phản ứng hoàn toàn với V lít khí Cl2 cùng điều kiện thu được chất A và HCl. Biết clo chiếm 83,53% khối lượng của A. Giá trị của V là
A. 2,24.
B. 4,48.
C. 3,36.
D. 6,72.
Lời giải
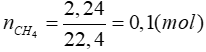
CTPT của A là CH4-xClx
Ta có:
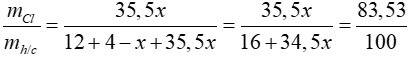
=> x = 2
=> A là CH2Cl2
Pthh: CH4 + 2Cl2 → CH2Cl2 + 2HCl
2,24 → 4,48 lít
=> V = 4,48 (l)
Đáp án: B
Bài 5: Đốt cháy hoàn toàn một ankan thu được 2,24 lít khí CO2 và 3,6 gam H2O. Công thức phân tử của ankan là
A. CH4. B. C2H6.
C. C3H8. D. C4H10.
Lời giải
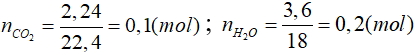
Cách 1:
PTHH: ![]()
Theo pt: n n + 1
Theo đb: 0,1 0,2
=> 0,2.n = 0,1.(n + 1) => n = 1
Vậy CTPT của ankan là: CH4
Cách 2:
nankan = nH2O - nCO2
⇒nankan = 0,2 - 0,1 = 0,1 (mol)
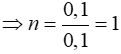
Vậy CTPT của ankan là: CH4
Đáp án: A
Bài 6: Đốt cháy hoàn toàn hỗn hợp gồm 2 ankan là đồng đẳng kế tiếp thu được 2,24 lít khí và 2,34 gam . Xác định CTPT của 2 ankan.
A. CH4 và C2H6.
B. C2H6 và C3H8.
C. C3H8 và C4H10.
D. CH4 và C3H8
Lời giải
![]()
Pthh
![]()
nankan = nH2O - nCO2
⇒nankan = 0,13 - 0,1 = 0,03 (mol)
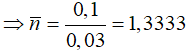
⇒ 2 ankan là: CH4, C2H6
Đáp án: A
Bài 7: Phản ứng của metan đặc trưng cho liên kết đơn là:
A. Phản ứng cháy
B. Phản ứng cộng
C. Phản ứng thế
D. Phản ứng trùng hợp
Lời giải
Phản ứng của metan đặc trưng cho liên kết đơn là: phản ứng thế
Đáp án: C
Bài 8: Chọn Bài đúng trong các Bài sau:
A. Metan có nhiều trong khí quyển
B. Metan có nhiều trong mỏ khí, mỏ dầu, mỏ than
C. Metan có nhiều trong nước biển
D. Metan sinh ra trong quá trình thực vật bị phân hủy.
Lời giải
Bài đúng là: Metan có nhiều trong mỏ khí, mỏ dầu, mỏ than
Đáp án: B
Bài 9: Trong các khí sau : CH4, H2, Cl2, O2. Khí nào khi trộn với nhau tạo ra hỗn hợp nổ ?
A. CH4 và Cl2.
B. H2 và O2.
C. CH4 và O2.
D. cả B và C đều đúng
Lời giải
Các hỗn hợp khí khi trộn với nhau tạo ra hỗn hợp nổ là: H2 và O2 và CH4 và O2.
Đáp án: D
Bài 10: Có bao nhiêu phát biểu đúng trong số các phát biểu sau:
a) Metan cháy với oxi tạo hơi nước và khí lưu huỳnh đioxit.
b) Phản ứng hóa học giữa metan và clo được gọi là phản ứng thế.
c) Trong phản ứng hóa học, giữa metan và clo, chỉ có duy nhất một nguyên tử hiđro của metan có thể được thay thế bởi nguyên tử clo.
d) Hỗn hợp gồm hai thể tích metan và một thể tích oxi là hỗn hợp nổ mạnh.
A. 1 B. 2
C. 3 D. 4
Lời giải
Phát biểu đúng: b). Vậy số phát biểu đúng là 1
Các phát biểu sai là:
a) Metan cháy với oxi tạo hơi nước và khí lưu huỳnh đioxit => Sai vì tạo khí cacbonic (CO2) chứ không phải là lưu huỳnh đioxit
c) Trong phản ứng hóa học giữa Metan và Clo, chỉ có duy nhất một nguyên tử Hiđro của Metan có thể được thay thế bởi nguyên tử Clo => Sai.
d) Hỗn hợp gồm hai thể tích Metan và một thể tích Oxi là hỗn hợp nổ mạnh => Sai, hỗn hợp nổ gồm một thể tích Metan và hai phần thể tích Oxi
Đáp án: A
Bài 11: Tính chất vật lí cơ bản của metan là
A. chất lỏng, không màu, tan nhiều trong nước.
B. chất khí, màu vàng lục, tan nhiều trong nước.
C. chất khí, không màu, mùi xốc, nặng hơn không khí, ít tan trong nước.
D. chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
Đáp án: D
Bài 12: Chất nào sau đây có phản ứng thế với clo?
A. CO2
B. Na
C. C
D. CH4
Đáp án: D
Bài 13: Đốt cháy khí metan bằng khí oxi. Nếu hỗn hợp nổ mạnh thì tỉ lệ thể tích của khí metan và khí oxi là
A. 1 thể tích khí metan và 3 thể tích khí oxi.
B. 2 thể tích khí metan và 1 thể tích khí oxi.
C. 1 thể tích khí metan và 2 thể tích khí oxi.
D. 3 thể tích khí metan và 2 thể tích oxi.
Đáp án: C
Bài 14: Cho các chất sau: H2O, HCl, Cl2, O2, CO2. Khí metan phản ứng được với
A. H2O, HCl.
B. Cl2, O2.
C. HCl, Cl2.
D. O2, CO2.
Đáp án: B
Bài 15: Phản ứng hóa học đặc trưng của metan là
A. phản ứng cộng.
B. phản ứng thế.
C. phản ứng tách.
D. phản ứng trùng hợp.
Đáp án: B
Bài 16: Đốt cháy hợp chất hữu cơ nào sau đây thu được số mol CO2 nhỏ hơn số mol H2O?
A. CH4
B. C4H6
C. C2H4
D. C6H6
Đáp án: A
Bài 17: Khí metan có lẫn khí cacbonic. Để thu được khí metan tinh khiết cần
A. Dẫn hỗn hợp qua nước vôi trong dư.
B. Đốt cháy hỗn hợp rồi dẫn qua nước vôi trong.
C. Dẫn hỗn hợp qua bình đựng dung dịch H2SO4.
D. Dẫn hỗn hợp qua bình đựng dung dịch brom dư.
Đáp án: A
Dẫn hỗn hợp khí qua nước vôi trong dư. Khí CO2 phản ứng bị giữ lại, khí metan không phản ứng thoát ra khỏi dung dịch thu được metan tinh khiết.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Bài 18: Cho các chất sau: CH4, Cl2, H2, O2. Có mấy cặp chất có thể tác dụng với nhau từng đôi một ?
A. 2
B. 3
C. 4
D. 5
Đáp án: C
Các cặp chất phản ứng với nhau là: CH4 và Cl2; CH4 và O2; Cl2 và H2; H2 và O2.
Bài 19: Thành phần phần trăm về khối lượng của các nguyên tố cacbon và hiđro trong CH4 lần lượt là
A. 50% và 50%.
B. 75% và 25%.
C. 80% và 20%.
D. 40% và 60%.
Đáp án: B
Bài 20: Khi đốt cháy hoàn toàn 0,5 mol metan người ta thu được một lượng khí CO2 (đktc) có thể tích là
A. 5,6 lít.
B. 11,2 lít.
C. 16,8 lít.
D. 8,96 lít.
Đáp án: B
VCO2 = 0,5.22,4 = 11,2 lít.
Trắc nghiệm Bài 37: Etilen
Bài 1: Hóa chất dùng để tách etilen khỏi hỗn hợp etan và etilen là
A. dung dịch NaOH.
B. dung dịch HCl
C. dung dịch brom.
D. dung dịch AgNO3.
Lời giải
Cho hỗn hợp khí qua dung dịch brom dư, etilen bị giữ lại, thu được etan không phản ứng thoát ra ngoài
CH2 = CH2 + Br2 → CH2Br = CH2Br
Đáp án: C
Bài 2: Chất nào sau đây vừa làm mất màu dung dịch brom, vừa tham gia phản ứng trùng hợp?
A. CH4.
B. CH3CH2OH.
C. CH3-CH3.
D. CH2=CH-CH3.
Lời giải
Chất vừa làm mất màu dung dịch brom, vừa tham gia phản ứng trùng hợp là chất có liên kết đôi (giống etilen)
=> CH2 = CH-CH3
Đáp án: D
Bài 3: Tính chất vật lí của etilen là
A. Chất lỏng, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
B. Chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
C. Chất khí, không màu, không mùi, ít tan trong nước và nặng hơn không khí.
D. Chất khí, không màu, không mùi, tan tốt trong nước và nhẹ hơn không khí.
Lời giải
Tính chất vật lí của etilen là: Chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
Đáp án: B
Bài 4: Ứng dụng nào sau đây không phải ứng dụng của etilen?
A. Điều chế PE.
B. Điều chế rượu etylic.
C. Điều chế khí ga.
D. Dùng để ủ trái cây mau chín.
Lời giải
Ứng dụng không phải của etilen là: Điều chế khí ga.
Đáp án: C
Bài 5: Phản ứng cháy giữa etilen và oxi thu được số mol CO2 và số mol H2O sinh ra theo tỉ lệ là:
A. 1 : 1 B. 2 : 1
C. 1 : 2 D. Kết quả khác
Lời giải
PTHH: C2H4 + 3O2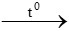 2CO2 + 2H2O
2CO2 + 2H2O
=> tỉ lệ số mol CO2 và số mol H2O là 1 : 1
Đáp án: A
Bài 6: Đốt cháy V lít etilen thu được 9 gam hơi nước. Thể tích không khí cần dùng (ở đktc), biết O2 chiếm 20% thể tích không khí?
A. 84,0 lít. B. 16,8 lít.
C. 56,0 lít. D. 44,8 lít
Lời giải
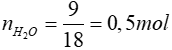
PTHH: C2H4 + 3O2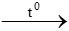 2CO2 + 2H2O
2CO2 + 2H2O
0,75 mol ← 0,5 mol
⇒ VO2 = 0,75.22,4 = 16,8 lít
Vì O2 chiếm 20% thể tích không khí => Vkhôngkhí = 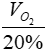 = 84 lít
= 84 lít
Đáp án: A
Bài 7: Dẫn 5,6 lít (đktc) khí metan và etilen đi qua bình đựng dung dịch nước brom, đã làm mất màu hoàn toàn dung dịch có chứa 4 gam brom. Thể tích khí metan (đktc) trong hỗn hợp là
A. 0,56 lít.
B. 5,04 lít.
C. 0,28 lít.
D. 3,36 lít
Lời giải
a) Dẫn 2 khí qua dung dịch nước brom chỉ có C2H4 phản ứng
C2H4 + Br2 → C2H4Br2
0,025 ← 0,025 mol
nCH4 = nhh - nC2H4 = 0,25 - 0,025 = 0,225 mol
VCH4 = 0,225.22,4 = 5,04 lít
Đáp án: B
Bài 8: Trong phân tử etilen có
A. 1 nguyên tử C
B. 2 nguyên tử C
C. 3 nguyên tử H
D. 6 nguyên tử H
Lời giải
Phân tử etilen có CTPT là C2H4
=> trong etilen có 2 nguyên tử C
Đáp án: B
Bài 9: CH4 và C2H4 giống nhau ở phản ứng nào sau đây?
A. tham gia phản ứng cộng với dung dịch brom.
B. tham gia phản ứng cộng với khí hiđro
C. tham gia phản ứng trùng hợp
D. tham gia phản ứng cháy với oxi.
Lời giải
CH4 và C2H4 có tính chất hóa học giống nhau là tham gia phản ứng cháy với oxi.
Đáp án: D
Bài 10: Cho các hợp chất sau: CH4, C2H6, C2H4, H2. Có bao nhiêu chất tác dụng với dung dịch nước brom ở nhiệt độ thường?
A. 1 B. 2
C. 3 D. 4
Lời giải
Chất tác dụng với dung dịch nước brom là C2H4 vì trong phân tử C2H4 có liên kết đôi
CH2 = CH2 + Br2 → CH2Br = CH2Br
Đáp án: A
Bài 11: Cho 2,8 lít hỗn hợp metan và etilen (đktc) lội qua dung dịch brom (dư), người ta thu được 4,7 gam đibroetan. Phần trăm thể tích của khí metan là
A. 20%. B. 40%.
C. 80%. D. 60%
Lời giải
![]()
PTHH: C2H4 + Br2 → C2H4Br2
0,025 ← 0,025
⇒ VC2H4 = 0,025.22,4 = 0,56 lít ⇒ VCH4 = 2,8 - 0,56 = 2,24 lít
![]()
Đáp án: C
Bài 12: Đốt cháy hết 36 gam hỗn hợp khí C3H6 và C2H6 trong O2 dư thu được 56 lít CO2 (đktc). Thể tích khí C3H6 ở đktc là
A. 11,2 lít B. 22,4 lít.
C. 33,6 lít. D. 44,8 lít.
Lời giải
Gọi số mol của C3H6 và C2H4 lần lượt là x và y mol
=> mhỗnhợp = 42x + 28y = 36 (1)
C3H6 + 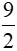 O2
O2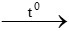 3CO2 + 3H2O
3CO2 + 3H2O
x mol → 3x mol
C2H6 + 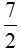 O2
O2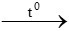 2CO2 + 3H2O
2CO2 + 3H2O
y mol → 2y mol
nCO2 = 3x + 2y = 2,5 mol (2)
Từ (1) và (2) ta có hệ:
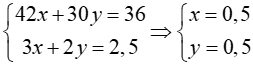
⇒VC3H6 = VC2H4 = 0,5.22,4 = 11,2 lít
Đáp án: A
Bài 13: Trong phân tử etilen giữa hai nguyên tử cacbon có
A. hai liên kết đôi.
B. một liên kết đôi.
C. một liên kết đơn.
D. một liên kết ba.
Đáp án: B
Bài 14: Etilen có tính chất vật lý nào sau đây?
A. là chất khí không màu, không mùi, tan nhiều trong nước, nhẹ hơn không khí.
B. là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
C. là chất khí màu vàng lục, mùi xốc, ít tan trong nước, nặng hơn không khí.
D. là chất khí không màu, mùi hắc, tan trong nước, nặng hơn không khí.
Đáp án: B
Bài 15: Khi đốt cháy khí etilen thì số mol CO2 và H2O được tạo thành theo tỉ lệ
A. 2 : 1.
B. 1 : 2.
C. 1 : 3.
D. 1 : 1.
Đáp án: D
Khi đốt cháy khí etilen thu được số mol CO2 bằng số mol nước.
Bài 16: Trong quá trình chín trái cây đã thoát ra một lượng nhỏ khí nào sau đây?
A. metan.
B. etan.
C. etilen.
D. axetilen.
Đáp án: C
Bài 17: Khí CH4 và C2H4 có tính chất hóa học giống nhau là
A. tham gia phản ứng cộng với dung dịch brom.
B. tham gia phản ứng thế với brom khi chiếu sáng.
C. tham gia phản ứng trùng hợp.
D. tham gia phản ứng cháy với khí oxi sinh ra khí cacbonic và nước.
Đáp án: D
Bài 18: Khí metan có lẫn một lượng nhỏ khí etilen. Để thu được metan tinh khiết, ta dẫn hỗn hợp khí qua
A. dung dịch brom.
B. dung dịch phenolphtalein.
C. dung dịch axit clohidric.
D. dung dịch nước vôi trong.
Đáp án: A
Dẫn hỗn hợp khí qua dung dịch brom. Khí etilen phản ứng với brom bị giữ lại trong dung dịch.
CH2 = CH2 + Br2 → Br – CH2 – CH2 – Br.
Khí metan không phản ứng thoát ra khỏi dung dịch, thu được metan tinh khiết.
Bài 19: Phản ứng đặc trưng của khí etilen là
A. phản ứng cháy.
B. phản ứng thế.
C. phản ứng cộng.
D. phản ứng phân hủy.
Đáp án: C
Bài 20: Trong phòng thí nghiệm, người ta đun rượu etylic với chất xúc tác là H2SO4 đặc, ở nhiệt độ 170°C để điều chế khí X. Khí X là
A. Cl2.
B. CH4.
C. C2H4.
D. C2H2.
Đáp án: C
Bài 21: Trùng hợp 1 mol etilen (với hiệu suất 100 %) ở điều kiện thích hợp thì thu được khối lượng polietilen là
A. 7 gam.
B. 14 gam.
C. 28 gam.
D. 56 gam.
Đáp án: C
Bảo toàn khối lượng có:
mtrước = msau ⇔ mpoli etilen = metilen = 1.28 = 28 gam.
Bài 22: Đốt cháy hoàn toàn 5,6 lít khí etilen ở đktc cần dùng lượng oxi (ở đktc) là
A. 11,2 lít.
B. 16,8 lít.
C. 22,4 lít.
D. 33,6 lít.
Đáp án: B
Trắc nghiệm Bài 38: Axetilen
Bài 1: Trong điều kiện nhiệt độ áp suất không đổi thì axetilen phản ứng với oxi theo tỉ lệ thể tích là
A. 2 lít khí C2H2 phản ứng với 4 lít khí O2.
B. 2 lít khí C2H2 phản ứng với 5 lít khí O2.
C. 3 lít khí C2H2 phản ứng với 2 lít khí O2.
D. 3 lít khí C2H2 phản ứng với 1 lít khí O2.
Lời giải
- Khi đốt trong không khí, axetilen cháy với ngọn lửa sáng, tỏa nhiều nhiệt
2C2H2 + 5O2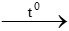 4CO2 + 2H2O
4CO2 + 2H2O
=> axetilen phản ứng với oxi theo tỉ lệ là: 2 lít khí C2H2 phản ứng với 5 lít khí O2.
Đáp án: B
Bài 2: Hãy cho biết trong các chất sau: C2H4, C3H4, C2H6, C2H2 có bao nhiêu chất làm mất màu dung dịch brom?
A. 1 B. 2
C. 3 D. 4
Lời giải
Các chất làm mất màu dung dịch brom là: C2H4, C3H4, C2H2.
C2H4 + Br2 → C2H4Br2
C3H4 + 2Br2 → C3H4Br4
C2H2 + 2Br2 → C2H2Br4
Đáp án: C
Bài 3: Khi đốt khí axetilen, số mol CO2 và H2O được tạo thành theo tỉ lệ là
A. 1 : 1. B. 1 : 2
C. 1 : 3. D. 2 : 1.
Lời giải
Phương trình đốt cháy axetilen: 2C2H2 + 5O2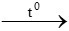 4CO2 + 2H2O
4CO2 + 2H2O
=> CO2 và H2O tạo thành theo tỉ lệ 4 : 2 = 2 : 1
Đáp án: D
Bài 4: Khí axetilen không có tính chất hóa học nào sau đây ?
A. Phản ứng cộng với dung dịch brom.
B. Phản ứng cháy với oxi.
C. Phản ứng cộng với hiđro.
D. Phản ứng thế với clo ngoài ánh sáng.
Lời giải
Khí axetilen không có phản ứng thế với clo ngoài ánh sáng.
Đáp án: D
Bài 5: Dãy các chất nào sau đây đều làm mất màu dung dịch brom?
A. CH4 ; C6H6.
B. C2H4 ; C2H6.
C. CH4 ; C2H4
D. C2H4 ; C2H2.
Lời giải
2 chất đều làm mất màu dung dịch brom là: C2H4 ; C2H2.
Đáp án: D
Bài 6: Khí X có tỉ khối đối với oxi là 0,8125. Khí X là
A. C2H2. B. C2H4.
C. C2H6. D. CH4.
Lời giải
MX = 0,8125.MO2 = 0,8125.32 = 26
Ta có: MC2H2 = 26; MC2H4 = 28; MC2H6 = 30; MCH4 = 16
=> khí X là C2H2
Đáp án: A
Bài 7: Tính chất vật lý của axetilen là
A. chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí.
B. chất khí không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
C. chất khí không màu, không mùi, tan tốt trong nước, nhẹ hơn không khí.
D. chất khí không màu, mùi hắc, ít tan trong nước, nặng hơn không khí.
Lời giải
Tính chất vật lý của axetilen là :
- Là chất khí, không màu, không mùi, nhẹ hơn không khí (d = 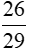 )
)
- Ít tan trong nước
Đáp án: B
Bài 8: Cấu tạo phân tử axetilen gồm
A. hai liên kết đơn và một liên kết ba.
B. hai liên kết đơn và một liên kết đôi.
C. một liên kết ba và một liên kết đôi.
D. hai liên kết đôi và một liên kết ba.
Lời giải
- Công thức cấu tạo của axetilen:
=> cấu tạo phân tử axetilen gồm:
+ Có 1 liên kết ba giữa 2 nguyên tử cacbon
+ Trong liên kết ba có 2 liên kết kém bền, dễ bị đứt lần lượt trong phản ứng hóa học
Đáp án: A
Bài 9: Trong phân tử axetilen, giữa hai nguyên tử cacbon có
A. một liên kết đơn.
B. một liên kết đôi
C. một liên kết ba.
D. hai liên kết đôi.
Lời giải
- Công thức cấu tạo của axetilen:
=> Trong phân tử axetilen, giữa hai nguyên tử cacbon có một liên kết ba
Đáp án: C
Bài 10: Liên kết C≡C trong phân tử axetilen có
A. một liên kết kém bền dễ đứt ra trong các phản ứng hóa học.
B. hai liên kết kém bền nhưng chỉ có một liên kết bị đứt ra trong phản ứng hóa học.
C. hai liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
D. ba liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
Lời giải
Liên kết C≡C trong phân tử axetilen có hai liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
Đáp án: C
Bài 11: Phương pháp hiện đại để điều chế axetilen hiện nay là
A. nhiệt phân etilen ở nhiệt độ cao.
B. nhiệt phân benzen ở nhiệt độ cao.
C. nhiệt phân canxi cacbua ở nhiệt độ cao.
D. nhiệt phân metan ở nhiệt độ cao.
Lời giải
Phương pháp hiện đại để điều chế axetilen hiện nay là nhiệt phân metan ở nhiệt độ cao.
2CH4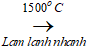 C2H2 + 3H2
C2H2 + 3H2
Đáp án: D
Bài 12: Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại, đó là
A. metan. B. etilen.
C. axetilen. D. etan
Lời giải
Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại, đó là axetilen.
Đáp án: C
Bài 13: Cho sơ đồ chuyển hóa sau:
X + H2O → Y + Z
Y + O2 → T + H2O
T + Z → CaCO3 + H2O
X, Y, Z, T lần lượt là
A. CaC2, CO2, C2H2, Ca(OH)2.
B. CaC2,C2H2, CO2, Ca(OH)2
C. CaC2, C2H2, Ca(OH)2, CO2.
D. CO2, C2H2, CaC2, Ca(OH)2.
Lời giải
CaC2 + 2H2O → C2H2↑ + Ca(OH)2
(X) (Y) (Z)
2C2H2 + 5O2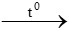 4CO2 + 2H2O
4CO2 + 2H2O
(Y) (T)
CO2 + Ca(OH)2 → CaCO3 + H2O
(T) (Z)
=> X, Y, Z, T lần lượt là CaC2, C2H2, Ca(OH)2, CO2
Đáp án: C
Bài 14: Đốt cháy hoàn toàn 1 mol khí axetilen thì cần bao nhiêu lít không khí (các khí đo ở đktc, biết rằng oxi chiếm 20% thể tích không khí) ?
A. 300 lít. B. 280 lít.
C. 240 lít. D. 120 lít.
Lời giải
Phương trình đốt cháy khí axetilen:
2C2H2 + 5O2 4CO2 + 2H2O
1 mol → 2,5 mol
⇒VO2 = 2,5.22,4 = 56 lít
Vì khí oxi chiếm 20% thể tích không khí => Vkhôngkhí = 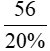 = 280 lít
= 280 lít
Đáp án: B
Bài 15: Đốt hoàn toàn 24 ml hỗn hợp axetilen và metan phải dùng 54 ml oxi (các thể tích khí đo ở đktc). Thể tích khí CO2 sinh ra là
A. 24 ml. B. 30 ml.
C. 36 ml. D. 42 ml.
Lời giải
Gọi thể tích của CH4 và C2H2 lần lượt là x và y ml
=> Vhỗnhợp = x + y = 24 ml (1)
CH4 + 2O2 → CO2 + 2H2O
x → 2x → x
2C2H2 + 5O2 → 4CO2 + 2H2O
y → 2,5y → 2y
⇒∑VO2 = 2x +2,5y = 54 ml (2)
Từ (1), (2) ta có hệ phương trình:
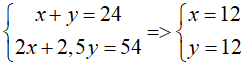
⇒VCO2 = x + 2y = 36 ml
Đáp án: C
Bài 16: Đốt cháy hoàn toàn 5,6 lít hỗn hợp khí metan và axetilen cần dùng 13,44 lít khí oxi. Phần trăm thể tích mỗi khí trong hỗn hợp là
A. CH4 40% và C2H2 60%.
B. CH4 80% và C2H2 20%.
C. CH4 20% và C2H2 80%.
D. CH4 60% và C2H2 40%.
Gọi số mol của CH4 và C2H2 lần lượt là x và y mol
Đáp án: C
Bài 17: Cho 0,448 lít (đktc) hỗn hợp khí gồm C2H4, C2H2 tác dụng hết với dung dịch brom dư, khối lượng brom đã tham gia phản ứng là 4,8 gam. Số mol khí C2H4 trong hỗn hợp ban đầu là
A. 0,02.
B. 0,01.
C. 0,015.
D. 0,005.
Đáp án: B
Bài 18: Có 3 bình, mỗi bình chứa 1 trong các khí sau: metan, axetilen, khí cacbonic. Đánh số A, B, C vào các bình này và tiến hành các thí nghiệm với từng chất khí. Kết quả thí nghiệm được ghi ở bảng sau:
| Thuốc thử | A | B | C |
| Dung dịch brom | Không hiện tượng | Mất màu | Không hiện tượng |
| Dung dịch nước vôi trong | Không hiện tượng | Không hiện tượng | Vẩn đục |
Hãy cho biết 3 bình A, B, C chứa lần lượt những khí nào?
A. Bình A chứa axetilen, bình B chứa metan, bình C chứa cacbonic.
B. Bình A chứa metan, bình B chứa axetilen, bình C chứa cacbonic.
C. Bình A chứa axetilen, bình B chứa cacbonic, bình C chứa metan.
D. Bình A chứa cacbonic, bình B chứa metan, bình C chứa axetilen.
Khí làm mất màu dung dịch brom là axetilen ⇒ Bình B chứa axetilen
Khí làm vẩn đục nước vôi trong là cacbonic ⇒ Bình C chứa cacbonic
Khí không phản ứng với cả 2 chất là metan ⇒ Bình A chứa metan
Đáp án: B
Bài 19: Trong phân tử axetilen, giữa hai nguyên tử cacbon có
A. một liên kết đơn.
B. một liên kết đôi.
C. một liên kết ba.
D. hai liên kết đôi.
Đáp án: C
Bài 20: Axetilen có tính chất vật lý nào sau đây
A. là chất khí không màu, mùi xốc, ít tan trong nước, nặng hơn không khí.
B. là chất khí không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
C. là chất khí không màu, không mùi, tan nhiều trong nước, nhẹ hơn không khí .
D. là chất khí không màu, mùi hắc, ít tan trong nước, nặng hơn không khí.
Đáp án: B
Bài 21: Khí axetilen không có tính chất hóa học nào sau đây?
A. Phản ứng cộng với dung dịch brom.
B. Phản ứng cháy với oxi.
C. Phản ứng thế với clo ngoài ánh sáng.
D. Phản ứng cộng với hiđro.
Đáp án: C
Bài 22: Phương pháp hiện đại để điều chế axetilen hiện nay là
A. nhiệt phân etilen ở nhiệt độ cao.
B. nhiệt phân benzen ở nhiệt độ cao.
C. nhiệt phân canxi cacbua ở nhiệt độ cao.
D. nhiệt phân metan ở nhiệt độ cao.
Đáp án: D
Bài 23: Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại, đó là
A. metan.
B. etilen.
C. axetilen.
D. etan.
Đáp án: C
Bài 24: Dãy các chất nào sau đây đều làm mất màu dung dịch brom?
A. CH4; C6H6.
B. CH4; C2H6.
C. CH4; C2H4.
D. C2H4; C2H2.
Đáp án: D
Bài 25: Dẫn 0,1 mol khí axetilen qua bình đựng dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 16,0 gam.
B. 20,0 gam.
C. 26,0 gam.
D. 32,0 gam.
Đáp án: D
→ mBrom pư = 0,2.160 = 32 gam.
Bài 26: Thể tích không khí cần dùng để đốt cháy hoàn toàn 1 mol axetilen là (các khí đo ở đktc, biết rằng oxi chiếm 20% thể tích không khí) ?
A. 300 lít.
B. 280 lít.
C. 240 lít.
D. 120 lít.
Đáp án: B
→ VO2 pư = 2,5.22,4 = 56 lít → Vkk = 56.5 = 280 lít.
Bài 27: Trong điều kiện thích hợp 1 mol khí axetilen tác dụng hoàn toàn với 2 mol khí hiđro, thu được chất khí là
A. C3H6.
B. C2H6.
C. C3H4,
D. C2H4.
Đáp án: B
C2H2 + 2H2 → C2H6
Bài 28: Cho 0,56 lít (đktc) hỗn hợp khí metan và axetilen tác dụng với dung dịch brom dư, lượng brom đã tham gia phản ứng là 5,6 gam. Thành phần phần trăm về thể tích của axetilen trong hỗn hợp ban đầu lần lượt là
A. 20%.
B. 70%.
C. 40%.
D. 60%.
Đáp án: B
Cho hỗn hợp khí qua dung dịch brom dư chỉ có axetilen phản ứng
Trắc nghiệm Bài 39: Benzen
Bài 1: Tính khối lượng benzen cần dùng để điều chế 23,55 gam brombenzen. Biết hiệu suất phản ứng đạt 85%.
A. 11,7 gam. B. 13,77 gam.
C. 14,625 gam. D. 9,945 gam.
Lời giải
![]()
Phương trình phản ứng:
C6H6Br + Br2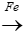 C6H5Br + HBr
C6H5Br + HBr
0,15 ← 0,15 ← 0,15 (mol)
mbenzentheolíthuyết = 0,15.78 = 11,7 gam.
Vì hiệu suất chỉ đạt 85% => khối lượng benzen cần dùng là:
mbenzen = ![]()
Đáp án: B
Bài 2: Cho brom phản ứng với benzen tạo ra brombenzen (bột sắt làm xúc tác). Tính khối lượng benzen cần dùng để điều chế 15,7 gam brombenzen. Biết hiệu suất của quá trình phản ứng là 80%.
A. 9,75 gam.
B. 6,24 gam.
C. 7,80 gam.
D. 10,53 gam
Lời giải
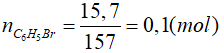
Phương trình hóa học:
![]()
0,1 ← 0,1 (mol)
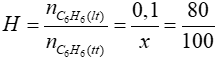
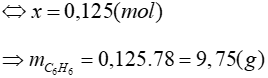
Đáp án: A
Bài 3: Đốt cháy hòa toàn 15,6 gam benzen rồi hấp thụ sản phẩm cháy vào bình đựng dung dịch nước vôi trong dư. Khối lượng dung dịch tăng hay giảm bao nhiêu gam?
A. tăng 56,4 gam.
B. giảm 28,2 gam.
C. giảm 56,4 gam.
D. tăng 28,2 gam
Lời giải
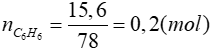
Phương trình hóa học:
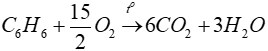
0,2 → 1,2 → 0,6 (mol)
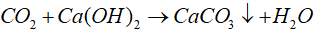
1,2 → 1,2 (mol)
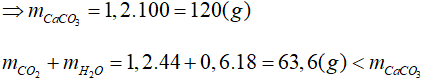
⇒ khối lượng dung dịch giảm là:
120 − 63,6 = 56,4 ( g )
Đáp án: C
Bài 4: Phản ứng nào sau đây không xảy ra?
A. Benzen + Cl2 (as).
B. Benzen + H2 (Ni, p, to).
C. Benzen + Br2 (dd).
D. Benzen + HNO3 (đ)/H2SO4 (đ).
Lời giải
Phản ứng không xảy ra là: benzen + Br2 (dd).
Benzen chỉ phản ứng với brom nguyên chất và có mặt xúc tác Fe, không phản ứng với dung dịch nước brom
Đáp án: C
Bài 5: Tính chất nào không phải của benzen là
A. Dễ thế.
B. Khó cộng.
C. Bền với chất oxi hóa.
D. Kém bền với các chất oxi hóa.
Lời giải
Tính chất nào không phải của benzen là kém bền với các chất oxi hóa.
Đáp án: D
Bài 6: Cho benzen + Cl2 (as) ta thu được dẫn xuất clo A. Vậy A là:
A. C6H5Cl.
B. C6H4Cl2.
C. C6H6Cl6.
D. C6H3Cl3.
Lời giải
Cho benzen + Cl2 (as) ta thu được dẫn xuất clo A.
C6H6 + 3Cl2 C6H6Cl6
C6H6Cl6
Đáp án: C
Bài 7: Tính chất nào không phải của benzen ?
A. Tác dụng với Br2 (to, Fe).
B. Tác dụng với HNO3 /H2SO4 (đ).
C. Tác dụng với dung dịch KMnO4.
D. Tác dụng với Cl2 (as).
Lời giải
Tính chất không phải của benzen là tác dụng với dung dịch KMnO4
Đáp án: C
Bài 8: Cho 7,8 gam benzen phản ứng với brom dư (có bột sắt xúc tác) hiệu suất phản ứng là 80%. Khối lượng brombenzen thu được là
A. 12,56 gam.
B. 15,7 gam.
C. 19,625 gam.
D. 23,8 gam.
Đáp án: A
Khối lượng brombenzen tính theo lý thuyết là: mLT = 0,1.157 = 15,7 gam.
Do hiệu suất phản ứng là 80% nên khối lượng brombenzen thực tế thu được là:
Bài 9: Đốt cháy chất nào sau đây thu được số mol CO2 lớn hơn số mol nước?
A. metan.
B. etilen.
C. benzen.
D. etilen và benzen.
Đáp án: C
Vậy đốt cháy benzen thu được số mol CO2 lớn hơn số mol nước.
Bài 10: Benzen có ứng dụng nào sau đây?
A. Làm nguyên liệu sản xuất chất dẻo, thuốc trừ sâu, dược phẩm…
B. Làm nhiên liệu trong đèn xì.
C. Làm nguyên liệu sản xuất PE.
D. Kích thích hoa quả mau chín.
Đáp án: A
Bài 11: Tính chất vật lý nào sau đây của benzen là sai?
A. Benzen là chất lỏng, không màu.
B. Benzen độc.
C. Benzen không tan trong nước.
D. Benzen nặng hơn nước.
Đáp án: D
D sai vì benzen nhẹ hơn nước.
Bài 12: Cấu tạo đặc biệt của phân tử benzen là
A. Phân tử có vòng.
B. Phân tử có 3 liên kết đôi.
C. Phân tử có vòng 6 cạnh, chứa các liên kết đôi.
D. Phân tử có vòng 6 cạnh, chứa 3 liên kết đôi xen kẽ với 3 liên kết đơn.
Đáp án: D
Bài 13: Phản ứng đặc trưng của benzen là
A. phản ứng cháy.
B. phản ứng trùng hợp.
C. phản ứng thế với brom (có bột sắt xúc tác).
D. phản ứng hóa hợp với brom (có bột sắt xúc tác).
Đáp án: C
Bài 14: Trong các phản ứng sau phản ứng hóa học đúng là
Đáp án: B
Bài 15: Một hợp chất hữu cơ A có phân tử khối là 78 đvC. Vậy A là
A. axetilen.
B. metan.
C. etilen.
D. benzen.
Đáp án: D
Bài 16: Tính khối lượng benzen cần dùng để điều chế được 31,4 gam brombenzen? Biết hiệu suất phản ứng là 85%
A. 15,6 gam.
B. 13,26 gam.
C. 18,353 gam.
D. 32 gam.
Đáp án: C
Theo PTHH có: nbenzen = nbrombenzen = 0,2 mol
→ Khối lượng benzen theo lý thuyết: mLT = n.M = 0,2.78 = 15,6 gam.
Do hiệu suất phản ứng là 85% → khối lượng brom thực tế là:
Bài 17: Cần bao nhiêu kg oxi để đốt cháy hết 3,9 kg benzen?
A. 24 kg
B. 12 kg
C. 16 kg
D. 36 kg
Đáp án: B
Bài 18: Cho 7,8 gam benzen phản ứng với brom dư (có bột sắt xúc tác) hiệu suất phản ứng là 80%. Khối lượng brombenzen thu được là
A. 12,56 gam.
B. 15,7 gam.
C. 19,625 gam.
D. 23,8 gam.
Đáp án: A
Khối lượng brombenzen tính theo lý thuyết là: mLT = 0,1.157 = 15,7 gam.
Do hiệu suất phản ứng là 80% nên khối lượng brombenzen thực tế thu được là:
Bài 19: Đốt cháy chất nào sau đây thu được số mol CO2 lớn hơn số mol nước?
A. metan.
B. etilen.
C. benzen.
D. etilen và benzen.
Đáp án: C
Vậy đốt cháy benzen thu được số mol CO2 lớn hơn số mol nước.
Bài 20: Benzen có ứng dụng nào sau đây?
A. Làm nguyên liệu sản xuất chất dẻo, thuốc trừ sâu, dược phẩm…
B. Làm nhiên liệu trong đèn xì.
C. Làm nguyên liệu sản xuất PE.
D. Kích thích hoa quả mau chín.
Đáp án: A
Trắc nghiệm Bài 40: Dầu mỏ và khí thiên nhiên
Bài 1: Cho các Bài sau:
a) Dầu mỏ là một đơn chất.
b) Dầu mỏ là một hợp chất phức tạp.
c) Dầu mỏ là một hỗn hợp tự nhiên của nhiều loại Hiđrocacbon.
d) Dầu mỏ sôi ở một nhiệt độ xác định.
e) Dầu mỏ sôi ở những nhiệt độ khác nhau.
Số Bài đúng là
A. 1 B. 2
C. 3 D. 4
Lời giải
Bài đúng là Bài c và Bài e.
c) Dầu mỏ là một hỗn hợp tự nhiên của nhiều loại Hiđrocacbon.
e) Dầu mỏ sôi ở những nhiệt độ khác nhau.
Những Bài sai là:
a), b) và d) sai vì dầu mỏ là một hỗn hợp phức tạp của nhiều loại hiđrocacbon và 1 số hợp chất khác
Đáp án: B
Bài 2: Ở nông thôn có thể dùng phân gia súc, gia cầm, rác hữu cơ để ủ trong các hầm Bio-gas. Dưới ảnh hưởng của các vi sinh vật yếm khí, chất hữu cơ sẽ phân hủy tạo ra một loại phân bón chất lượng cao. Bio-gas dùng để đun nấu trong gia đình. Nên phát triển các hầm Bio-gas vì
A. Vốn đầu tư không lớn.
B. Đảm bảo vệ sinh môi trường và mầm các bệnh bị tiêu diệt
C. Có nguồn năng lượng sạch và thuận tiện.
D. Tất cả các lý do trên.
Lời giải
Nên phát triển các hầm Bio-gas vì
- Vốn đầu tư không lớn
- Đảm bảo vệ sinh môi trường và mầm các bệnh bị tiêu diệt
- Có nguồn năng lượng sạch và thuận tiện
Đáp án: D
Bài 3: Để dập tắt xăng dầu cháy người ta sẽ:
A. Phun nước vào ngọn lửa.
B. Dùng chăn ướt chùm lên ngọn lửa.
C. Phủ cát lên ngọn lửa.
D. Cả B và C đều đúng.
Lời giải
Cách làm đúng là B và C vì ngăn không cho xăng, dầu tiếp xúc với không khí.
Cách làm A là sai vì khi đó dầu loang nhanh trên mặt nước, gây cháy diện rộng hơn.
Đáp án: D
Bài 4: Sự cố tràn dầu do chìm tàu chở dầu là thảm họa môi trường vì:
A. Do dầu không tan trong nước
B. Do dầu sôi ở những nhiệt độ khác nhau
C. Do dầu nhẹ hơn nước, nổi trên mặt nước cản sự hòa tan của khí oxi làm các sinh vật dưới nước bị chết
D. Dầu lan rộng trên mặt nước bị sóng, gió cuốn đi xa rất khó xử lý.
Lời giải
Sự cố tràn dầu do chìm tàu chở dầu là thảm họa môi trường vì do dầu nhẹ hơn nước, nổi trên mặt nước cản sự hòa tan của khí oxi làm các sinh vật dưới nước bị chết
Đáp án: C
Bài 5: Đốt cháy V lít khí thiên nhiên chứa 96% CH4, 2% N2 và 2% CO2 về thể tích. Toàn bộ sản phẩm cháy được dẫn qua dung dịch Ca(OH)2 dư thấy tạo ra 4,9 gam kết tủa. Giá trị của V là
A. 1,12 lít. B. 2,24 lít.
C. 3,36 lít. D. 4,48 lít.
Lời giải
CH4 + 2O2 CO2 + 2H2O (1)
CO2 + 2H2O (1)
CO2 + Ca(OH)2 → CaCO3 + H2O (2)
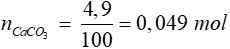
Giả sử số mol của V lít khí thiên nhiên là x (mol) => chứa khí CH4 0,96x mol
CH4 + 2O2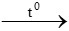 CO2 + 2H2O
CO2 + 2H2O
0,96x → 0,96x
⇒ ∑nCO2(2) = 0,96x + 0,02x = 0,98x mol
CO2 + Ca(OH)2 → CaCO3 + H2O
0,98x mol → 0,98x mol
=> nCaCO3 = 0,98x = 0,049 => x = 0,05 mol
⇒VCO2 = 0,05.22,4 = 1.12 lít
Đáp án: A
Bài 6: Nhận xét nào sau đây là đúng về dầu mỏ?
A. Dầu mỏ là chất lỏng sánh, màu nâu đen, không tan trong nước, nhẹ hơn nước.
B. Dầu mỏ là chất lỏng sánh, màu đen, không tan trong nước, nặng hơn nước.
C. Dầu mỏ là chất lỏng sánh, màu nâu đen, tan trong nước, nhẹ hơn nước.
D. Dầu mỏ là chất lỏng sánh, màu nâu đen, tan trong nước, nặng hơn nước.
Đáp án: A
Bài 7: Để dập tắt đám cháy nhỏ do xăng, dầu người ta dùng biện pháp
A. phun nước vào ngọn lửa.
B. phủ cát vào ngọn lửa.
C. thổi oxi vào ngọn lửa.
D. phun dung dịch muối ăn vào ngọn lửa.
Đáp án: B
Bài 8: Thành phần chính của khí đồng hành (hay khí mỏ dầu) là
A. H2.
B. CH4.
C. C2H4.
D. C2H2.
Đáp án: B
Bài 9: Dầu mỏ nước ta có hàm lượng hợp chất chứa lưu huỳnh là
A. nhỏ hơn 0,5%.
B. lớn hơn 0,5%.
C. bằng 0,5%.
D. bằng 0,05%.
Đáp án: A
Bài 10: Crăckinh dầu mỏ để thu được
A. hỗn hợp gồm nhiều hiđrocacbon có phân tử khối nhỏ hơn.
B. hỗn hợp gồm nhiều hiđrocacbon có phân tử khối lớn hơn.
C. hiđrocacbon nguyên chất.
D. dầu thô.
Đáp án: A
Bài 11: Trên mũi khoan để khai thác dầu mỏ người ta có gắn
A. thép.
B. gang.
C. kim cương.
D. bạc.
Đáp án: C
Bài 12: Thành phần chủ yếu của khí thiên nhiên là
A. hiđro.
B. metan.
C. etilen.
D. axetilen.
Đáp án: B
Bài 13: Nhận xét nào sau đây là sai?
A. Dầu mỏ là hỗn hợp tự nhiên của nhiều loại hiđrocacbon.
B. Dầu mỏ và khí thiên nhiên là nguồn nhiên liệu và nguyên liệu quý trong đời sống và sản xuất.
C. Crackinh dầu mỏ để tăng thêm lượng xăng.
D. Khí thiên nhiên là do cây quang hợp sinh ra.
Đáp án: D
Bài 14: Thể tích oxi cần dùng để đốt cháy hoàn toàn 10 lít khí thiên nhiên chứa 96% metan; 2% nitơ và 2% khí cacbon đioxit là (các thể tích khí đo trong cùng điều kiện nhiệt độ, áp suất)
A. 9,6 lít.
B. 19,2 lít.
C. 28,8 lít.
D. 4,8 lít.
Đáp án: B
Theo bài ra, trong 10 lít khí thiên nhiên có 9,6 lít CH4; 0,2 lít N2 và 0,2 lít CO2.
Đốt cháy khí thiên nhiên có phản ứng hóa học sau:
Ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol.
Theo PTHH cứ 1 mol CH4 phản ứng cần 2 mol O2
→ Cứ 9,6 lít CH4 phản ứng cần 9,6.2 = 19,2 lít O2.
Bài 15: Đốt hoàn toàn V lít (ở đktc) khí thiên nhiên có chứa 96% CH4; 2% N2 và 2% CO2 rồi dẫn toàn bộ sản phẩm qua dung dịch nước vôi trong dư ta thu được 29,4 gam kết tủa. Giá trị của V là
A. 6,86 lít.
B. 6,72 lít.
C. 4,48 lít.
D. 67,2 lít.
Đáp án: B
Theo bài ra, cứ V lít khí thiên nhiên có 0,96V lít khí CH4; 0,02V lít N2 và 0,02V lít CO2.
Đốt cháy khí thiên nhiên có phản ứng hóa học sau:
Thể tích CO2 thu được sau khí đốt:
VCO2 = VCO2 ban đầu + VCO2 (1) = 0,02V + 0,96V = 0,98V (lít)
Cho sản phẩm cháy vào nước vôi trong dư:
Theo PTHH (2) có: nCO2 = n↓ vậy VCO2 = 0,294.22,4 = 0,98V
→ V = 6,72 lít.
Trắc nghiệm Bài 41: Nhiên liệu
Bài 1: Nhận định nào sau đây là sai?
A. Nhiên liệu là những chất cháy được, khi cháy tỏa nhiệt và phát sáng.
B. Nhiên liệu đóng vai trò quan trọng trong đời sống và sản xuất.
C. Nhiên liệu rắn gồm than mỏ, gỗ …
D. Nhiên liệu khí có năng suất tỏa nhiệt thấp, gây độc hại cho môi trường.
Đáp án: D
D sai vì Nhiên liệu khí có năng suất tỏa nhiệt cao, dễ cháy hoàn toàn, ít gây độc hại cho môi trường.
Bài 2: Trong các loại than dưới đây, loại than già nhất có hàm lượng cacbon trên 90% là
A. than gầy.
B. than mỡ.
C. than non.
D. than bùn.
Đáp án: A
Bài 3: Khí nào sau đây khi cháy không gây ô nhiễm môi trường?
A. CH4.
B. H2.
C. C4H10.
D. CO.
Đáp án: B
Khí H2 khi cháy sinh ra nước nên không gây ô nhiễm môi trường.
Bài 4: Loại than nào sau đây có hàm lượng cacbon thấp nhất ?
A. than gầy.
B. than mỡ.
C. than non.
D. than bùn.
Đáp án: D
Bài 5: Để sử dụng nhiên liệu cho hiệu quả cần đảm bảo yêu cầu nào sau đây?
A. Cung cấp đủ không khí hoặc oxi cho quá trình cháy .
B. Tăng diện tích tiếp xúc của nhiên liệu rắn với với không khí hoặc oxi .
C. Điều chỉnh lượng nhiên liệu để duy trì sự cháy phù hợp với nhu cầu sử dụng.
D. Cả 3 yêu cầu trên.
Đáp án: D
Bài 6: Loại nhiên liệu nào sau đây có năng suất tỏa nhiệt cao, dễ cháy hoàn toàn?
A. Nhiên liệu khí.
B. Nhiên liệu lỏng.
C. Nhiên liệu rắn.
D. Nhiên liệu hóa thạch.
Đáp án: A
Bài 7: Thể tích khí oxi (ở đktc) cần dùng để đốt cháy hoàn toàn 1 kg than có chứa 4% tạp chất không cháy là
A. 1,792 m3.
B. 4,48 m3.
C. 3,36 m3.
D. 6,72 m3.
Đáp án: A
Khối lượng cacbon có trong 1kg than trên là:
Vậy VO2 = 80.22,4 = 1792 lít = 1,792 m3.
Bài 8: Nhận xét nào sau đây là đúng?
A. Nhiên liệu lỏng được dùng chủ yếu trong đun nấu và thắp sáng.
B. Than mỏ gồm than cốc, than chì, than bùn.
C. Nhiên liệu khí dễ cháy hoàn toàn hơn nhiên liệu rắn.
D. Sử dụng than khi đun nấu góp phần bảo vệ môi trường.
Đáp án: C
Bài 9: Đốt hoàn toàn 12 gam than chứa 98% cacbon. Tỏa ra nhiệt lượng là (Biết rằng khi đốt 1 mol cacbon cháy tỏa ra 394 kj nhiệt lượng)
A. 788 kj.
B. 772,24 kj.
C. 386,12 kj.
D. 896 kj.
Đáp án: C
Khối lượng C trong 12 gam than là:
Nhiệt lượng tỏa ra là: Q = 0,98.344 = 386,12 kj.
Bài 10: Đốt một mẫu than (chứa tạp chất không cháy) có khối lượng 0,6 kg trong oxi dư thu được 1,06 m3 (đktc) khí cacbonic. Thành phần phần trăm khối lượng cacbon trong mẫu than trên là
A. 94,64.
B. 64,94.
C. 49,64.
D. 46,94.
Đáp án: A
Đổi 0,6 kg = 600 gam.
Đồi 1,06 m3 = 1060 lít → Vkhí = 1060 : 22,4 = 47,32 mol.
Bài 11: Để sử dụng nhiên liệu có hiệu quả cần phải cung cấp không khí hoặc oxi:
A. Vừa đủ.
B. Thiếu.
C. Dư.
D. cả B và C đều đúng.
Lời giải
Bài a đúng
Bài b sai vì nhiên liệu không cháy hết.
Bài c sai vì khi đó phải cung cấp năng lượng để làm nóng không khí dư
Đáp án: A
Bài 12: Vì sao không đun bếp than trong phòng kín?
A. Vì than tỏa nhiều nhiệt dẫn đến phòng quá nóng.
B. Vì than cháy tỏa ra rất nhiều khí CO, CO2 có thể gây tử vong nếu ngửi quá nhiều trong phòng kín.
C. Vì than không cháy được trong phòng kín.
D. Vì giá thành than khá cao.
Lời giải
Không đun bếp than trong phòng kín vì khi than cháy tỏa ra rất nhiều khí CO, CO2 có thể gây tử vong nếu ngửi quá nhiều trong phòng kín.
Đáp án: B
Bài 13: Hãy giải thích tại sao các chất khí dễ cháy hoàn toàn hơn các chất rắn và chất lỏng?
A. Vì chất khí nhẹ hơn chất rắn và chất lỏng.
B. Vì chất khí có nhiệt độ sôi thấp hơn chất rắn và chất lỏng.
C. Vì diện tích tiếp xúc của chất khí với không khí lớn hơn.
D. Vì chất khí có khối lượng riêng lớn hơn chất rắn và lỏng.
Lời giải
Chất khí dễ cháy hoàn toàn hơn các chất lỏng và chất rắn vì để tạo ra được hỗn hợp với không khí, khi đó diện tích tiếp xúc của nhiên liệu với không khí lớn hơn nhiều so với chất lỏng và chất rắn.
Đáp án: C
Bài 14: Biết 1 mol cacbon khi cháy hoàn toàn tỏa ra một nhiệt lượng là 394 kJ. Tính nhiệt lượng tỏa ra khi đốt cháy 5 kg than chứa 90% cacbon.
A. 147750 kJ
B. 147570 kJ
C. 145770 kJ
D. 174750 kJ
Lời giải
Khối lượng cacbon là:
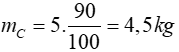
Đổi 4,5 kg = 4500 gam
Số mol cacbon đem đi đốt là:
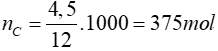
Nhiệt lượng tỏa ra là: 375.394 = 147750 kJ
Đáp án: A
Bài 15: Một mol khí etilen cháy hoàn toàn tỏa ra một lượng nhiệt 1423 kJ. Vậy 0,2 mol etilen cháy tỏa ra một lượng nhiệt Q là bao nhiêu kJ ?
A. 7115 kJ.
B. 246,8 kJ.
C. 264,8 kJ.
D. 284,6 kJ.
Lời giải
1 mol etilen tạo ra 1423kJ
0,2 mol etilen tạo ra 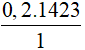 = 284,6 kJ
= 284,6 kJ
Đáp án: D
Trắc nghiệm Bài 42: Luyện tập chương 4 : Hiđrocacbon - Nhiên liệu
Bài 1: Chất có khả năng làm mất màu dung dịch brom là
A. CO2.
B. C2H4.
C. C2H6.
D. CH4.
Đáp án: B
Bài 2: Khí tham gia phản ứng trùng hợp là
A. CH4.
B. C2H4.
C. C3H8.
D. C2H6.
Đáp án: B
Bài 3: Chất khi tác dụng với nước sinh ra khí axetilen là
A. Al4C3.
B. CaC2.
C. CaO.
D. Na2S.
Đáp án: B
CaC2 + 2H2O → Ca(OH)2 + C2H2
Bài 4: Phân biệt metan và etilen dùng dung dịch nào sau đây ?
A. Br2
B. NaOH
C. NaCl
D. AgNO3 trong NH3
Đáp án: A
Khí etilen làm mất màu dung dịch brom ngay điều kiện thường, còn khí metan thì không.
C2H4 + Br2 → C2H4Br2
Bài 5: Benzen tác dụng với Br2 theo tỷ lệ mol 1 : 1 (có mặt bột Fe), thu được sản phẩm hữu cơ là
A. C6H6Br2
B. C6H6Br6
C. C6H5Br
D. C6H6Br4
Đáp án: C
Bài 6: Khi đốt cháy hoàn toàn 0,25 mol metan người ta thu được một lượng khí CO2 (đktc) có thể tích là
A. 5,6 lít.
B. 11,2 lít.
C. 16,8 lít.
D. 8,96 lít.
Đáp án: A
VCO2 = 0,25.22,4 = 5,6 lít.
Bài 7: Trùng hợp 14 gam etilen (với hiệu suất 100 %) ở điều kiện thích hợp thì thu được khối lượng polietilen là
A. 7 gam.
B. 14 gam.
C. 28 gam.
D. 56 gam.
Đáp án: B
Bảo toàn khối lượng có:
mtrước = msau ⇔ mpoli etilen = metilen = 14 gam.
Bài 8: Dẫn 0,05 mol khí axetilen qua bình đựng dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 16,0 gam.
B. 20,0 gam.
C. 26,0 gam.
D. 32,0 gam.
Đáp án: A
→ mBrom pư = 0,1.160 = 16 gam.
Bài 9: Một hợp chất hữu cơ A có phân tử khối là 28 đvC. Vậy A là
A. axetilen.
B. metan.
C. etilen.
D. benzen.
Đáp án: A
Bài 10: Tính khối lượng benzen cần dùng để điều chế được 15,7 gam brombenzen ? Biết hiệu suất phản ứng là 80%
A. 15,6 gam.
B. 7,8 gam.
C. 9,75gam.
D. 16 gam.
Đáp án: C
Theo PTHH có: nbenzen = nbrombenzen = 0,1 mol
→ Khối lượng benzen theo lý thuyết: mLT = n.M = 0,1.78 = 7,8 gam.
Do hiệu suất phản ứng là 80% → khối lượng brom thực tế là: