Tailieumoi.vn giới thiệu Giải bài tập Hóa học 9 Bài 27. Cacbon chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Cacbon lớp 9.
Giải bài tập Hóa học 9 Bài 27. Cacbon
Bài 1 trang 84 SGK Hóa học 9: Dạng thù hình của nguyên tố là gì ? Cho hai thí dụ.
Lời giải:
- Dạng thù hình của nguyên tố là những đơn chất khác nhau do cùng một nguyên tố hóa học tạo nên.
- Một nguyên tố hóa học có thể tạo ra hai hay nhiều đơn chất. Ví dụ:
Cacbon có 3 dạng thù hình: kim cương, than chì, cacbon vô định hình.
Phopho có 2 dạng thù hình là: photpho trắng, photpho đỏ.
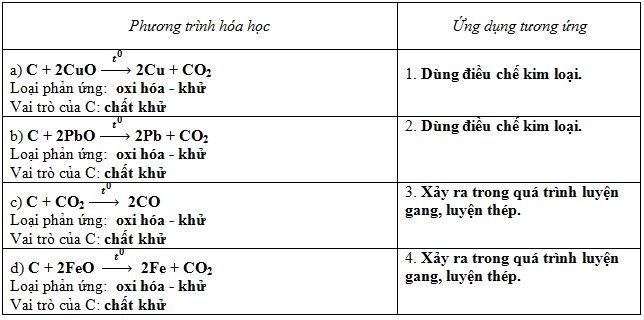
Bài 2 trang 84 SGK Hóa học 9: Viết phương trình hoá học của cacbon với các oxit sau:
a) CuO ;
b) PbO ;
c) CO2;
d) FeO.
Hãy cho biết loại phản ứng ; vai trò của C trong các phản ứng ; ứng dụng của các phản ứng đó trong sản xuất.
Lời giải:
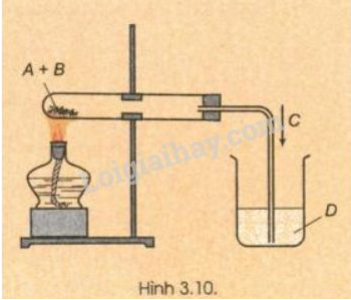
Lời giải:
A là CuO,
B là C (cacbon),
C là khí CO2,
D là dung dịch Ca(OH)2
Hiện tượng: Có chất rắn màu đỏ (Cu) tạo thành, nước vôi trong vẩn đục.
Phương trình hóa học:
C(r) + 2CuO(r) CO2(k) + 2Cu(r)
Bài 4 trang 84 SGK Hóa học 9: Tại sao sử dụng than để đun nấu, nung gạch ngói, nung vôi lại gây ô nhiễm môi trường. Hãy nêu biện pháp chống ô nhiễm môi trường và giải thích.
Lời giải:
Khi sử dụng than để đun nấu, nung gạch ngói, nung vôi gây ô nhiễm môi trường vì: đều sinh ra CO2, CO, SO2 (trong than có cả lưu huỳnh lẫn vào). Những khí này đều ảnh hưởng không tốt cho con người, gây độc, gây mưa axit, gây hiệu ứng “nhà kính” làm biến đổi khí hậu...
- Biện pháp chống ô nhiễm môi trường :
+ Xây lò nung vôi, gạch ngói ở nơi xa dân cư
+ Trồng cây xanh vì khi đó cây xanh hấp thụ khí CO2 và giải phóng khí O2.
Bài 5 trang 84 SGK Hóa học 9: Trong công nghiệp, người ta sử dụng cacbon để làm nhiên liệu. Tính nhiệt lượng toả ra khi đốt cháy 5 kg than chứa 90% cacbon, biết 1 mol cacbon cháy toả ra 394 kJ.
Phương pháp giải:
- Tính khối lượng C nguyên chất chứa trong mẫu than.
- Tính số mol C: nC=mC/12
- Từ đó tính được nhiệt lượng tỏa ra: Q = nC.394
Lời giải:
Khối lượng C có trong 5 kg than là:
mC = = 4,5 kg = 4500 gam ; nC= 4500/12=375 mol
Nhiệt tỏa ra khi đốt cháy 5 kg than là:
375. 394 = 147750 kJ
I. CÁC DẠNG THÙ HÌNH CỦA CACBON
- Dạng thù hình của một nguyên tố là những đơn chất khác nhau do cùng một nguyên tố tạo nên.
Thí dụ: oxi O2, ozon O3 là hai dạng thù hình của nguyên tố oxi.
- Nguyên tố cacbon có 3 dạng thù hình là:
+ Kim cương: cứng, trong suốt, không dẫn điện.
+ Than chì: mềm, dẫn điện.
+ Cacbon vô định hình (than đá, than gỗ, than xương): xốp, không dẫn điện.
III. TÍNH CHẤT CỦA CACBON
1. Tính chất hấp phụ
- Than gỗ có khả năng giữ trên bề mặt của nó các chất khí, chất hơi, chất tan trong dung dịch. Than gỗ có tính hấp phụ
- Than hoạt tính có tính hấp phụ cao được dùng để làm trắng đường, chế tạo mặt nạ phòng độc...
2. Tính chất hóa học
a) Tác dụng với oxi
Khi đốt cacbon cháy trong không khí, phản ứng tỏa nhiều nhiệt:
C + O2 CO2
Ở nhiệt độ cao, cacbon khử được CO2 theo phản ứng
CO2 + C 2CO
Do đó, sản phẩm khi đốt cacbon trong không khí, ngoài khí CO2 còn có một ít khí CO.
b) Tác dụng với oxit kim loại
- Ở nhiệt độ cao, C khử được oxit kim loại (đứng sau Al) để tạo thành kim loại và khí CO2
C + CuO Cu + CO2
- Trong luyện kim người ta sử dụng tính chất này của cacbon để điều chế kim loại.
III. ỨNG DỤNG CỦA CACBON
- Kim cương được sử dụng làm đồ trang sức. Trong kĩ thuật, kim cương được dùng để chế tạo mũi khoan, dao cắt thủy tinh và bột mài.
- Than chì được dùng làm điện cực; làm nồi, chén để nấu chảy các hợp kim chịu nhiệt; chế tạo chất bôi trơn; làm bút chì đen.
- Than cốc được dùng làm chất khử trong luyện kim để luyện kim loại từ quặng.
- Than gỗ được dùng để chế thuốc nổ đen, thuốc pháo, chất hấp thụ. Loại than có khả năng hấp thụ mạnh được gọi là than hoạt tính. Than hoạt tính được dùng nhiều trong mặt nạ phòng độc, trong công nghiệp hóa chất và trong y học.
- Than muội được dùng làm chất độn khi lưu hóa cao su, để sản xuất mực in, xi đánh giày,...
Sơ đồ tư duy: Cacbon

A. Kim cương
B. Than chì
C. Fuleren
D. Cả A, B, C và cacbon vô định hình
Hướng dẫn giải chi tiết:
Cacbon tạo thành một số dạng thù hình là: Kim cương, than chì, fuleren và cacbon vô địch hình.
Đáp án D
Câu 2: Cacbon có thể tạo với oxi hai oxit là:
A. CO, CO3
B. CO2, CO3
C. CO, CO2
D. CO2, C2O4
Hướng dẫn giải chi tiết:
Cacbon có thể tạo với oxi 2 oxit là CO, CO2
C + O2 CO2
C + CO2 2CO
Đáp án C
Câu 3: Để chứng minh sự có mặt của khí CO và CO2 trong hỗn hợp, người ta dẫn hỗn hợp khí qua (1) thấy xuất hiện kết tủa trắng, sau đó dẫn khí còn lại qua (2) thấy có chất rắn màu đỏ xuất hiện. Hoá chất đem sử dụng ở (1), (2) lần lượt là:
A. Nước vôi trong; đồng (II) oxit nung nóng.
B. Kali hiđroxit, nhôm oxit
C. Natri hiđroxit, đồng (II) oxit nung nóng.
D. Nước vôi trong; nhôm oxit
Hướng dẫn giải chi tiết:
Dẫn hỗn hợp khí qua (1) thấy xuất hiện kết tủa trắng => (1) là dung dịch nước vôi trong Ca(OH)2
=> khí CO2 bị hấp thụ, còn lại khí CO thoát ra khỏi bình
PTHH: CO2 + Ca(OH)2 → CaCO3 + H2O
Dẫn CO qua (2) thấy chất rắn màu đỏ xuất hiện => chất rắn đó là Cu
=> (2) là CuO
PTHH: CO + CuO Cu + CO2
Đáp án A
Câu 4: Trong luyện kim, người ta sử dụng cacbon và hoá chất nào để điều chế kim loại ?
A. Một số oxit kim loại như PbO, ZnO, CuO, ...
B. Một số bazơ như NaOH, Ca(OH)2, Cu(OH)2, ...
C. Một số axit như HNO3; H2SO4; H3PO4, ....
D. Một số muối như NaCl, CaCl2, CuCl2,...
Hướng dẫn giải chi tiết:
Trong luyện kim, người ta sử dụng cacbon và oxit của kim loại để điều chế kim loại
Đáp án A
Câu 5: Đốt cháy m gam C cần V lít O2 (đktc) thu được 15,68 lít hỗn hợp khí X gồm CO, CO2 có tỉ lệ về số mol là 3:4. Giá trị m, V lần lượt là
Hướng dẫn giải chi tiết:
mol (1)
(2)
Từ (1) và (2) ⟹ nCO = 0,3 mol; mol.
⟹ nC = 0,3 + 0,4 = 0,7 mol.
⟹ m = mC = 0,7.12 = 8,4 gam.
⟹ mol.
⟹ V = 0,55.22,4 = 12,32 lít.
Đáp án C
Câu 6: Nung 18g FeO với C dư. Toàn bộ lượng CO2 sinh ra được dẫn vào bình đựng 100ml dung dịch NaOH nồng độ a M, sau phản ứng thu được dung dịch A. Dung dịch A có khả năng tác dụng tối đa 100ml dung dịch KOH 1M.
a)Viết phương trình hóa học xảy ra
b)Giá trị của a là bao nhiêu?
c) Xác định thành phần % các muối thu được sau phản ứng
Hướng dẫn giải chi tiết:
a) Các PTHH xảy ra:
2FeO + C 2Fe + CO2 (1)
CO2 + NaOH → NaHCO3 (2)
CO2 + 2NaOH → Na2CO3 + H2O (3)
2NaHCO3 + 2KOH → Na2CO3 + K2CO3 + 2H2O (4)
b)
nCO2 = ½ nFeO = 0,25/2 = 0,125 (mol)
Toàn bộ CO2 hấp thụ vào NaOH thu được dd A . Dd A phản ứng được với KOH nên trong dung dich A chắc chắn phải có NaHCO3
Vậy khi CO2 phản ứng với dd NaOH có thể xảy ra các trường hợp sau:
TH1: Chỉ xảy ra phản ứng tạo muối NaHCO3.
NaOH phản ứng hết, CO2 hết hoặc dư, mọi tính toán theo NaHCO3
CO2 + NaOH → NaHCO3 (2)
0,1 ←0,1 ←0,1 (mol)
nCO2(2) = nNaHCO3 = 0,1 (mol) < 0,125 mol => CO2 dư => không phù hợp với bài toán là hấp thụ hết CO2 => loại
TH2: Xảy ra phản ứng tạo muối Na2CO3 và NaHCO3. Cả CO2 và NaOH đều phản ứng hết
CO2+ NaOH → NaHCO3 (2)
0,1 ←0,1 ←0,1
CO2 + 2NaOH → Na2CO3 + H2O (3)
(0,125-0,1) → 0,05→ 0,025 (mol)
∑ nNaOH = 0,1 + 0,05= 0,15 (mol)
=> CM NaOH = nNaOH : VNaOH = 0,15 : 0,1 = 1,5 (M)
c)
Sau phản ứng dd A với KOH thu được dd B có chứa: Na2CO3 và K2CO3
2NaHCO3 + 2KOH → Na2CO3 + K2CO3 + 2H2O (4)
0,1 ←0,1 → 0,05 →0,05 (mol)
nK2CO3(4) = 1/2nKOH = ½. 0,1 = 0,05 (mol) => mK2CO3(4) = 0,05. 138 = 6,9 (g)
∑ nNa2CO3 = nNa2CO3 (3) + nNa2CO3(4) = 0,025 + 0,05 = 0,075 (mol)
=> ∑ mNa2CO3 = 0,075.106 = 7,95 (g)
Tổng khối lượng 2 muối là: m = mK2CO3 + mNa2CO3 = 6,9 + 7,95 = 14,85(g)
Câu 7: Cho hơi nước đi qua than nóng đỏ thu được hỗn hợp khí CO và H2 ( khí than ướt). Thể tích hỗn hợp khí ở điều kiện tiêu chuẩn thu được từ 1 tấn than chứa 92% cacbon là bao nhiêu ?
Biết hiệu suất phản ứng đạt 85%.
Hướng dẫn giải chi tiết:
1 tấn= 1000 kg
Khối lượng cacbon có trong 1 tấn than là:
C + H2O CO + H2
Theo pư Cứ 12g 22,4 l 22,4l
Hay 12 kg 22,4 m3 22,4 m3
Vậy 920 kg x m3 x m3
=>m tổng thể tích 2 khí thu được theo lí thuyết là (H=100%) = 2×1717,33=3434,66(m3)
Vì H= 85% => Tổng thể tích khí thu được là:
Câu 8: Cho 10,8 gam nhôm tác dụng vừa đủ với 3,6 gam cacbon thu được muối X. Công thức hóa học của muối X là
Hướng dẫn giải chi tiết:
Gọi công thức muối X là AlxCy.
Theo PTHH ⟹
.
⟹ CT của X là Al4C3.
Câu 9: Cho bột than dư vào hỗn hợp 2 oxit Fe2O3 và CuO đun nóng để phản ứng xảy ra hoàn toàn thu được 3,68g hỗn hợp kim loại và 1,568lít khí (đktc). Khối lượng hỗn hợp 2 oxit ban đầu là:
Hướng dẫn giải chi tiết:
n khí = V hh khí : 22,4 = 1,568 : 22,4 = 0,07 mol
Gọi x và y lần lượt là số mol của Fe2O3 và CuO
Fe2O3 + 3C → 3CO + 2Fe
CuO + C → CO + Cu
Nhận thấy nC = nCO = 0,07 mol
=> mC =0,84g
m CO = 0,07 . 28 = 1,96g
Áp dụng ĐLBT khối lượng ta có
m hh oxit = mhhKL + mCO - mC =3,68 + 1,96 - 0,84 = 4,8g
Câu 10: Lượng nhiệt tỏa ra khi đốt cháy 10 kg than cốc có chứa 84% C (biết 1 mol C cháy tỏa ra 396 kJ, C = 12) là:
Hướng dẫn giải chi tiết:
mC = 10 . 84% = 8,4kg = 8400g
=> nC = mC : MC = 8400 : 12 = 700mol
Lượng nhiệt tỏa ra Q = 700 . 396 = 277200kJ