Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 9 Bài 44: Rượu etylic chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Rượu etylic lớp 9.
Giải bài tập Hóa học lớp 9 Bài 44: Rượu etylic
Câu hỏi và bài tập ( trang 139 SGK Hóa học 9)
Bài 1 trang 139 SGK Hóa học 9: Rượu etylic phản ứng được với natri vì:
A. trong phân tử có nguyên tử oxi.
B. trong phân tử có nguyên tử hiđro và nguyên tử oxi.
C. trong phân tử có nguyên tử cacbon, hiđro, oxi.
D. trong phân tử có nhóm -OH.
Lời giải :
Rượu etylic phản ứng được với natri vì trong phân tử có nhóm -OH
Đáp án D
Bài 2 trang 139 SGK Hóa học 9: Trong số các chất sau: CH3-CH3,CH3-CH2OH,C6H6,CH3-O-CH3 chất nào tác dụng được với Na? Viết phương trình hóa học.
Phương pháp giải:
Những chất trong phân tử có nhóm -OH phản ứng với Na.
Lời giải:
Các chất CH3-CH3 , C6H6 , CH3-O-CH3, không phản ứng với Na vì không có nhóm –OH
CH3-CH2-OH phản ứng được với Na vì có nhóm –OH
Phương trình hóa học:
2CH3-CH2-OH + 2Na ---------- > 2 CH3-CH2-ONa + H2↑
Bài 3 trang 139 SGK Hóa học 9: Có ba ống nghiệm :
Ống 1 đựng rượu etylic;
Ống 2 đựng rượu 96o;
Ống 3 đựng nước.
Cho Na dư vào các ống nghiệm trên, viết các phương trình hóa học.
Lời giải :
Phản ứng xảy ra ở: ống 1, ống 2 và ống 3
- Ống 1 : Rượu etylic phản ứng với Na
2CH3 – CH2 – OH + 2Na 2CH3 – CH2 – ONa + H2
- Ống 2 : Rượu 96 độ bao gồm rượu etylic và nước nên bao gồm 2 phản ứng của rượu etylic với Na và nước với Na
2H2O + 2Na 2NaOH + H2
2CH3 – CH2 – OH + 2Na 2CH3 – CH2 – ONa + H2
- Ống 3 : Nước tác dụng với Na
2H2O + 2Na 2NaOH + H2
Bài 4 trang 139 SGK Hóa học 9: Trên nhãn của chai rượu đều có ghi các số, thí dụ 45o,18o, 12o.
a) Hãy giải thích ý nghĩa của các số trên.
b) Tính số ml rượu etylic có trong 500 ml rượu 45o.
c) Có thể pha chế được bao nhiêu lít rượu 25o từ 500 ml rượu 45o ?
Phương pháp giải :
Nắm được khái niệm độ rượu: Số ml rượu nguyên chất có trong 100ml hỗn hợp rượu và nước.
Lời giải:
a) Các con số 45o, 18o, 12o là các con số chỉ độ rượu hay phần thể tích của rượu C2H5OH có trong 100 phần thể tích của hỗn hợp (rượu và nước). Các con số trên có ý nghĩa là :
Trong 100ml hỗn hợp (rượu và nước) có 45ml, 18ml, 12ml C2H5OH.
b) Rượu 45o nghĩa là :
100ml rượu có 45ml C2H5OH.
Vậy 500ml rượu có x ml C2H5OH.
ml.
c) Theo câu b, 500 ml rượu 45 độ có 225 ml rượu C2H5OH.
Rượu 25o nghĩa là :
100ml rượu 25o có 25ml C2H5OH.
Vậy V ml rượu 25o có 225 ml C2H5OH.
V =
Bài 5 trang 139 SGK Hóa học 9: Đốt cháy hoàn toàn 9,2 gam rượu etylic.
a) Tính thể tích khí CO2 tạo ra ở điều kiện tiêu chuẩn.
b) Tính thể tích không khí (ở điều kiện tiêu chuẩn) cần dùng cho phản ứng trên, biết oxi chiếm 20% thể tích của không khí.
Phương pháp giải :
Tính toán theo PTHH.
Lời giải :
Số mol C2H5OH = 9,2 : 46 = 0,2 (mol).
Phương trình hóa học của phản ứng cháy :
C2H5OH + 3O2 -> 2CO2 + 3H2O.
0,2 0,6 0,4 mol
a)
Theo phương trình:
Thể tích khí CO2 tạo ra là : VCO2 = 0,4.22,4 = 8,96 (lít).
b)
Theo phương trình:
Thể tích khí oxi cần dùng là : VO2 = 0,6 . 22,4 = 13,44 (lít).
Vậy thể tích không khí cần dùng là Vkhông khí = (lít).
Công thức phân tử rượu etylic: C2H6O
Phân tử khối: 46
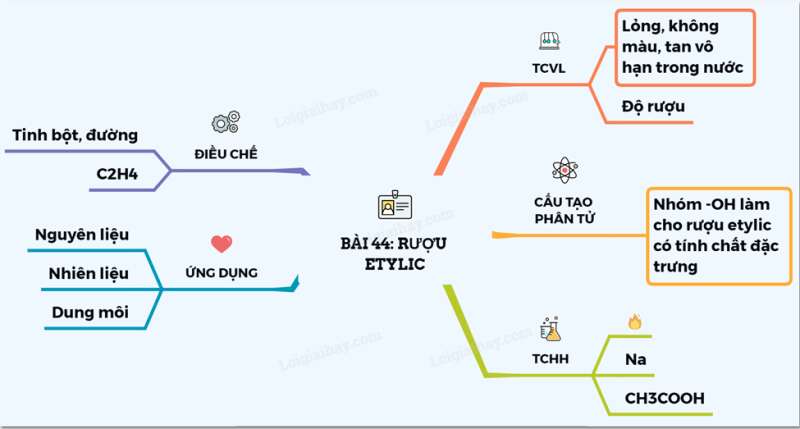
I. Tính chất vật lí
1. Khái niệm
- Rượu etylic là chất lỏng không màu, sôi ở 78,3oC
- Nhẹ hơn nước và tan vô hạn trong nước. Rượu etylic hòa tan được nhiều chất như iot, benzen,…
2. Độ rượu và cách tính độ rượu
- Độ rượu là số ml rượu etylic nguyên chất có trong 100 ml hỗn hợp rượu etylic với nước.
Công thức: Độ rượu =
V là thể tích đo bằng ml hoặc lít
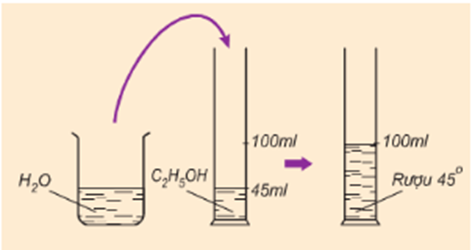
Hình 1: Cách pha rượu 45o
II. Cấu tạo phân tử
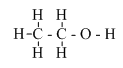
- Công thức cấu tạo thu gọn: CH3 – CH2 – OH
- Trong phân tử, rượu etylic có một nguyên tử H không kiên kết với nguyên tử C mà liên kết với nguyên tử oxi tạo ra nhóm –OH. Chính nhóm –OH này làm cho rượu có tính chất hóa học đặc trưng.
III. Tính chất hóa học.
1. Phản ứng cháy
Rượu etylic cháy với ngọn lửa màu xanh, tỏa nhiều nhiệt.
C2H5OH + 3O2 2CO2 + 3H2O
2. Tác dụng với kim loại mạnh như K, Na,...
2C2H5OH + 2Na 2C2H5ONa + H2.
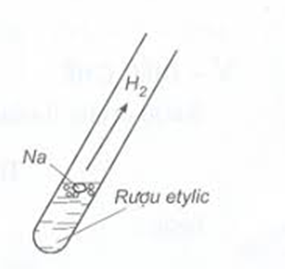
Hình 2: Minh họa thí nghiệm rượu etylic tác dụng với Na.
3. Tác dụng với axit.
Thí dụ: Tác dụng với axit axetic có H2SO4 đặc tạo ra este và nước
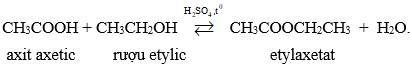
IV. Ứng dụng.
- Rượu etylic được dùng làm nhiên liệu cho động cơ ôtô, cho đèn cồn trong phòng thí nghiệm.
- Làm nguyên liệu sản xuất axit axetic, dược phẩm, cao su tổng hợp.
- Dùng pha chế các loại rượu uống,...
V. Điều chế
- Phương pháp 1: Điều chế rượu làm đồ uống
Tinh bột hoặc đường glucozơ rượu etylic
PTHH: C6H12O6 2CO2 + 2C2H5OH
- Phương pháp 2: Sản xuất rượu phục vụ ngành công nghiệp
Cho etilen cộng hợp với nước có axit làm xúc tác
CH2=CH2 + H2O C2H5OH
Chú ý: Những hợp chất hữu cơ phân tử có nhóm OH, có công thức phân tử chung là CnH2n+1OH gọi là ancol no, đơn chức hay ankanol cũng có tính chất tương tự rượu etylic.
Sơ đồ tư duy: Rượu etylic
Phương giải bài tập về độ rượu
* Phương pháp giải
Bài tập về độ rượu thường sử dụng 2 công thức sau:
Độ rượu =
Trong đó:
là thể tích dung dịch C2H5OH nguyên chất, đơn vị: ml
là thể tích dung dịch rượu (gồm C2H5OH và H2O), đơn vị: ml
D là khối lượng riêng, thường có đơn vị là g/ml.
* Khi cho hỗn hợp ancol và nước phản ứng với kim loại kiềm thì nước phản ứng trước.