Với giải Bài 4 trang 98 Hóa học lớp 10 Cánh diều chi tiết trong Bài 16: Tốc độ phản ứng hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 16: Tốc độ phản ứng hóa học
Bài 4 trang 98 Hóa học 10: Cùng một lượng kim loại Zn phản ứng với cùng một thể tích dung dịch H2SO4 1M, nhưng ở hai nhiệt độ khác nhau.
Zn + H2SO4 → ZnSO4 + H2
Thể tích khí H2 sinh ra ở mỗi thí nghiệm theo thời gian được biểu diễn ở đồ thị bên
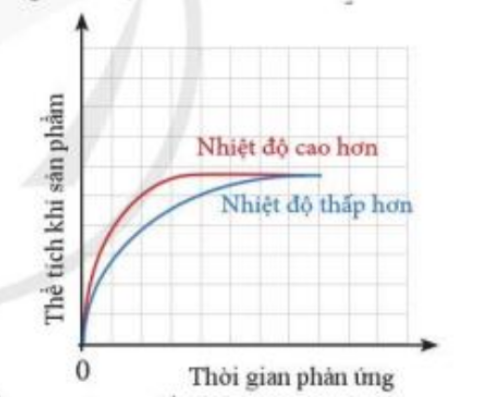
a) Giải thích vì sao đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh
b) Vì sao sau một thời gian, hai đường đồ thị lại chụm lại với nhau?
Phương pháp giải:
a) Nhiệt độ càng cao, tốc độ phản ứng diễn ra càng nhanh
b) Sau một thời gian, phản ứng diễn ra hoàn toàn, chất tham gia phản ứng hết
Lời giải:
a)
- Đường màu đỏ biểu diễn tốc độ phản ứng ở nhiệt độ cao hơn
- Đường màu xanh biểu diễn tốc độ phản ứng ở nhiệt độ thấp hơn
- Trong phản ứng hóa học, nhiệt độ càng cao, tốc độ phản ứng diễn ra càng nhanh
=> Đường màu đỏ ban đầu cao hơn đường màu xanh
b)
- Sau 1 thời gian, phản ứng diễn ra hoàn toàn, chất tham gia phản ứng hết
- Vì lượng chất tham gia là như nhau => Lượng chất sản phẩm tạo thành là bằng nhau
=> Sau một thời gian, hai đường đồ thị chụm lại với nhau (thể tích khí H2 là bằng nhau)
Bài tập vận dụng:
Câu 1. Công thức liên hệ giữa hệ số Van’t Hoff với tốc độ phản ứng và nhiệt độ là
A. =
B. =
C. =
D. =
Đáp án: A
Giải thích:
Công thức liên hệ giữa hệ số Van’t Hoff với tốc độ phản ứng và nhiệt độ là =
Câu 2. Đơn vị tốc độ phản ứng v là
A. mol L−1 s−1
B. m s
C. M s−1
D. Cả A và C
Đáp án: D
Giải thích:
Đơn vị tốc độ phản ứng v là: (đơn vị nồng độ) (đơn vị thời gian)−1
Ví dụ: mol L−1 s−1; M s−1
Câu 3. Cho phản ứng phản ứng:
|
|
2N2O5 (g)
|
⟶ 4NO2 (g)
|
+ O2 (g)
|
|
|
t1 = 0 s
|
0,03
|
0
|
0
|
(M)
|
|
t2 = 100s
|
0,02535
|
0,0093
|
0,002325
|
(M)
|
Tốc độ trung bình của phản ứng trong 100 s đầu tiên tính theo N2O5 (g) là
A. 2,325.10−5 M s−1
B. 4,65.10−5 M s−1
C. 9,3.10−5 M s−1
D. 1,55.10−5 M s−1
Đáp án: A
Giải thích:
Tốc độ trung bình của phản ứng trong 100 s đầu tiên là:
= 2,325.10−5 (M s−1)
Xem thêm lời giải bài tập Hóa Học 10 Cánh diều hay, chi tiết khác:
Mở đầu trang 88 Hóa học 10: Cho hai mảnh Mg cùng khối lượng vào hai ống nghiệm chứa cùng thể tích dung dịch HCl dư, nồng độ dung dịch HCl...
Câu hỏi 1 trang 89 Hóa học 10: Trong cùng một khoảng thời gian, nồng độ của MgCl2 ở dung dịch nào tăng lên nhanh hơn? Giải thích...
Câu hỏi 2 trang 89 Hóa học 10: Tốc độ của phản ứng (1) ở dung dịch HCl 2M là nhanh hơn hay chậm hơn so với ở dung dịch HCl 0,5M?...
Câu hỏi 3 trang 90 Hóa học 10: Cho biết tốc độ phản ứng chỉ nhận giá trị dương. Giải thích vì sao phải thêm dấu trừ trong biểu thức (3) khi tính tốc độ trung bình của phản ứng theo các chất tham gia phản ứng...
Luyện tập 1 trang 90 Hóa học 10: Tính tốc độ trung bình của phản ứng (4) theo O2 trong 100 giây đầu tiên...
Luyện tập 2 trang 90 Hóa học 10: Từ Bảng 16.1, có thể tính được tốc độ trung bình của phản ứng sau 50 giây hay không? Vì sao? ...
Vận dụng 1 trang 90 Hóa học 10: Hãy sắp xếp tốc độ các phản ứng sau theo chiều tăng dần: (1) phản ứng than cháy trong không khí, (2) phàn ứng gỉ sắt, (3) phản ứng nổ của khí bình gas...
Vận dụng 2 trang 91 Hóa học 10: Thực phẩm bị ôi thiu do các phản ứng oxi hóa của oxygen cũng như sự hoạt động của vi khuẩn....
Câu hỏi 4 trang 92 Hóa học 10: Em có nhận xét gì nếu trong biểu thức (5), nồng độ của chất A và B đều bằng 1M?...
Câu hỏi 5 trang 92 Hóa học 10: Trong phản ứng (6), nếu nồng độ của H2tăng gấp đôi thì tốc độ phản ứng thay đổi như thế nào?...
Câu hỏi 6 trang 93 Hóa học 10: Khi nồng độ của H2(g) cũng như I2(g) đều tăng lên gấp đôi thì tốc độ phản ứng của H2(g) với I2(g) tăng lên mấy lần?...
Vận dụng 3 trang 93 Hóa học 10: Hãy giải thích các hiện tượng dưới đây....
Câu hỏi 7 trang 94 Hóa học 10: Quan sát hình 16.4, giải thích vì sao khi dùng đá vôi dạng bột thì tốc độ phản ứng nhanh hơn ...
Vận dụng 4 trang 94 Hóa học 10: Giải thích vì sao thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn...
Câu hỏi 8 trang 95 Hóa học 10: Cho hai đinh sắt tương tự nhau (tẩy sạch gỉ và dầu mỡ) vào hai ống nghiệm chứa cùng một thể tích dung dịch HCl 1M....
Câu hỏi 9 trang 95 Hóa học 10: Dựa vào.. hiện tượng nào để so sánh tốc độ phản ứng trong 2 thí nghiệm trên...
Câu hỏi 10 trang 95 Hóa học 10: Với phản ứng có γ = 2, nếu nhiệt độ tăng từ 20oC lên 50oC thì tốc độ phản ứng tăng bao nhiêu lần...
Vận dụng 5 trang 97 Hóa học 10: Enzyme amylase và lipase có trong nước bọt. Hãy giải thích vì sao chúng ta cần phải nhai kĩ thức ăn trước khi nuốt....
Bài 1 trang 98 Hóa học 10: Nồi áp suất dùng để ninh, hầm thức ăn có thể làm nóng nước tới nhiệt độ 120oC so với 100oC khi dùng nồi thường...
Bài 2 trang 98 Hóa học 10: Hình ảnh bên minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng? Giải thích...
Bài 3 trang 98 Hóa học 10: Khí H2 có thể được điều chế bằng cách cho miếng sắt vào dung dịch HCl. Hãy đề xuất các biện pháp khác nhau để làm tăng tốc độ điều chế khí H2...
Bài 5 trang 98 Hóa học 10: Phản ứng A → sản phẩm được thực hiện trong bình kín. Nồng độ của A tại các thời điểm t = 0, t = 1 phút, t = 2 phút lần lượt là 0,1563M; 0,1496M; 0,1431M...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 14 : Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài 16: Tốc độ phản ứng hóa học
Bài 17: Nguyên tố và đơn chất halogen
Bài 18: Hydrogen halide và hydrohalic acid
