Với giải Vận dụng 3 trang 93 Hóa học lớp 10 Cánh diều chi tiết trong Bài 16: Tốc độ phản ứng hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 16: Tốc độ phản ứng hóa học
Vận dụng 3 trang 93 Hóa học 10: Hãy giải thích các hiện tượng dưới đây.
a) Khi ở nơi đông người trong một không gian kín, ta cảm thấy khó thở và phải thở nhanh hơn
b) Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất
c) Bệnh nhân suy hô hấp cần thở oxygen thay vì không khí (chứa 21% thể tích oxygen)
Phương pháp giải:
a) Coi người và oxygen là chất tham gia phản ứng
=> Ở nơi đông người, nồng độ oxygen giảm đi nhiều để cung cấp cho con người => Lượng oxygen bị thiếu hụt
b)
- Oxygen cung cấp sự cháy
- Oxygen nguyên chất có nồng độ oxygen cao hơn trong không khí
c)
- Oxygen duy trì sự sống
- Khi bệnh nhân suy hô hấp => Tốc độ hô hấp giảm
Lời giải:
a) Ở nơi đông người, nồng độ oxygen giảm đi nhiều để cung cấp cho con người
=> Lượng oxygen bị hao hụt và loãng
=> Con người bị thiếu oxygen nên cảm thấy khó thở và phải thở nhanh hơn để lấy oxygen
b) Khi cho tàn đóm vào bình oxygen nguyên chất
=> Nồng độ oxygen tăng cao (vì oxygen nguyên chất có nồng độ cao hơn nhiều so với oxygen trong không khí)
=> Giúp cho phản ứng xảy ra nhanh và mạnh hơn
=> Tàn đón đỏ bùng cháy
c)
- Khi con người bị suy hô hấp => Tốc độ hô hấp giảm => Không cung cấp đủ khí oxygen cho con người
- Áp dụng định luật tác dụng khối lượng => Cần phải tăng nồng độ của chất tham gia (khí oxygen) để tăng tốc độ hô hấp
=> Bệnh nhân cần phải thở oxygen (nồng độ 100%) thay vì không khí (nồng độ oxygen 21%)
Lý thuyết Các yếu tố ảnh hưởng tới tốc độ phản ứng, hệ số nhiệt độ Van’t Hoff
1. Ảnh hưởng của nồng độ
- Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn.
Ví dụ: Phản ứng của H2 và I2 như sau:
H2(g) + I2(g) 2HI(g) (6)
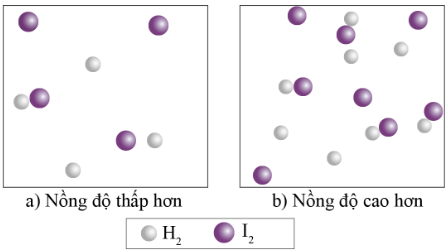
Hình 16.3. Ảnh hưởng của nồng độ các chất phản ứng tới tốc độ phản ứng
+ Giải thích: Khi nồng độ của H2 và I2 tăng lên trong một đơn vị thể tích, các phân tử này cũng sẽ nhiều hơn, dẫn đến số lượng va chạm giữa chúng (trong cùng một đơn vị thời gian) tăng lên. Vì vậy tốc độ phản ứng tăng lên khi nồng độ các chất tăng.
2. Ảnh hưởng của áp suất
- Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng càng lớn.
- Giải thích: Đối với các chất khí, nồng độ của chất khí tỉ lệ với áp suất của nó. Do vậy, khi áp suất chất tham gia phản ứng ở thể khí tăng lên, sẽ làm nồng độ chất khí tăng lên, từ đó làm tốc độ phản ứng tăng.
Ví dụ: Phản ứng tổng hợp NH3 từ N2 và H2 được thực hiện ở áp suất rất cao từ 200 – 300 atm để tăng tốc độ phản ứng.
3. Ảnh hưởng của diện tích bề mặt
- Thí nghiệm: Dùng hai mẫu Zn có cùng khối lượng, trong đó một mẫu dạng hạt còn một mẫu dạng bột. Cho hai mẫu đó cùng tác dụng với hai thể tích bằng nhau dung dịch H2SO4 loãng, dư, cùng nồng độ.
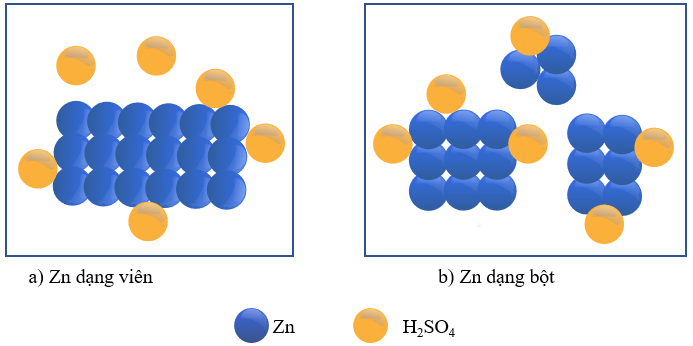
Hình 16.4. Ảnh hưởng của diện tích bề mặt tới tốc độ phản ứng
- Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn.
- Giải thích: Khi diện tích bề mặt tăng lên, dẫn đến số lượng va chạm giữa các chất phản ứng tăng lên (trong cùng một đơn vị thời gian) tăng lên. Vì vậy tốc độ phản ứng tăng lên khi nồng độ các chất tăng.
- Ảnh hưởng của diện tích bề mặt tới tốc độ phản ứng trong thực tế: thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn, than tổ ong có nhiều lỗ sẽ cháy nhanh hơn, ...
4. Ảnh hưởng của nhiệt độ
- Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị g = 2 ÷ 4 này được gọi là hệ số nhiệt độ Van’t Hoff.
- Mối liên hệ của hệ số nhiệt độ Van’t Hoff tới tốc độ và nhiệt độ như sau:
Trong đó, v2 và v1 là tốc độ phản ứng ở nhiệt độ T2 và T1 tương ứng.
- Ảnh hưởng của nhiệt độ tới tốc độ phản ứng trong thực tế: Nước nhanh sôi hơn khi được đun ở nhiệt độ cao; thức ăn bị chậm ôi, thiu khi được để trong tủ lạnh, ...
5. Ảnh hưởng của chất xúc tác
- Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị thay đổi cả về lượng và chất sau phản ứng.
Ví dụ 1: Khi đun nóng, KClO3 bị phân hủy tương đối chậm theo phương trình:
3KClO3(s) 3KCl(s) + 3O2(g)
Tuy nhiên tốc độ phản ứng phân hủy này sẽ nhanh hơn rất nhiều khi có mặt chất xúc tác MnO2. Kết thúc thí nghiệm trên, màu đen của MnO2 ban đầu vẫn giữ nguyên vì MnO2 không bị biến đổi sau phản ứng phân hủy KClO3.
- Ảnh hưởng của nhiệt độ tới tốc độ phản ứng trong thực tế:
+ Phản ứng tổng hợp NH3 từ N2 và H2 cần sử dụng chất xúc tác là sắt kim loại được trộn thêm Al2O3, K2O, ... để làm tăng tốc độ phản ứng, phản ứng không có chất xúc tác sẽ diễn ra rất chậm.
+ Các enzyme trong cơ thể là những chất xúc tác sinh học thúc đẩy các phản ứng sinh hóa phức tạp trong cơ thể chúng ta. Ví dụ enzyme amylase có trong nước ngọt giúp thủy phân tinh bột thành đường.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diều hay, chi tiết khác:
Vận dụng 4 trang 94 Hóa học 10: Giải thích vì sao thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 14 : Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài 16: Tốc độ phản ứng hóa học
Bài 17: Nguyên tố và đơn chất halogen
Bài 18: Hydrogen halide và hydrohalic acid