Với giải sách bài tập Hóa học 10 Bài 16: Tốc độ phản ứng hóa học sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải SBT Hóa học lớp 10 Bài 16: Tốc độ phản ứng hóa học
Bài 16.1 trang 49 sách bài tập Hóa học 10: Những phát biểu nào sau đây là đúng?
A. Tốc độ của phản ứng hoá học là đại lượng mô tả mức độ nhanh hay chậm của chất phản ứng được sử dụng hoặc sản phẩm được tạo thành.
B. Tốc độ của phản ứng hoá học là hiệu số nồng độ của một chất trong hỗn hợp phản ứng tại hai thời điểm khác nhau.
C. Tốc độ của phản ứng hoá học có thể có giá trị âm hoặc dương.
D. Trong cùng một phản ứng hoá học, tốc độ tạo thành của các chất sản phẩm khác nhau là khác nhau, tuỳ thuộc vào hệ số cân bằng của chúng trong phương trình hoá học.
E. Trong cùng một phản ứng hoá học, tốc độ tiêu thụ các chất phản ứng khác nhau sẽ như nhau nếu chúng được lấy với cùng một nồng độ.
Lời giải:
Đáp án đúng là: A và D
B sai vì tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
C sai vì tốc độ phản ứng có giá trị dương.
E sai vì trong cùng một phản ứng hoá học, tốc độ tiêu thụ của các chất phản ứng khác nhau là khác nhau, tuỳ thuộc vào hệ số cân bằng của chúng trong phương trình hoá học.
Bài 16.2 trang 49 sách bài tập Hóa học 10: Những phát biểu nào sau đây không đúng?
A. Tốc độ của phản ứng hoá học chỉ có thể được xác định theo sự thay đổi nồng độ chất phản ứng theo thời gian.
B. Tốc độ của phản ứng hoá học không thể xác định được từ sự thay đổi nồng độ chất sản phẩm tạo thành theo thời gian.
C. Theo công thức tính, tốc độ trung bình của phản ứng hoá học trong một khoảng thời gian nhất định là không thay đổi trong khoảng thời gian ấy.
D. Dấu “−” trong biểu thức tính tốc độ trung bình theo biến thiên nồng độ chất phản ứng là để đảm bảo cho giá trị của tốc độ phản ứng không âm.
E. Tốc độ trung bình của một phản ứng trong một khoảng thời gian nhất định được biểu thị bằng biến thiên nồng độ chất phản ứng hoặc sản phẩm tạo thành chia cho khoảng thời gian đó.
Lời giải:
Đáp án đúng là: A, B
Phát biểu A sai vì tốc độ của phản ứng đơn giản còn được xác định dựa vào định luật tác dụng khối lượng.
Phát biểu B sai vì tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
A. không đổi cho đến khi kết thúc.
B. tăng dần cho đến khi kết thúc.
C. chậm dần cho đến khi kết thúc.
D. tuân theo định luật tác dụng khối lượng.
Lời giải:
Đáp án đúng là: C
Khi cho một lượng xác định chất phản ứng vào bình để cho phản ứng hoá học xảy ra, tốc độ phản ứng sẽ chậm dần cho đến khi kết thúc.
Sau 2 phút, có 3 gam CaCl2 được hình thành theo phản ứng (1).
a) Xác định tốc độ trung bình của phản ứng (theo đơn vị mol phút -1) theo lượng sản phẩm được tạo ra.
b) Giả sử phản ứng (2) cũng xảy ra cùng một tốc độ trung bình như phản ứng (1), hãy tính số mol KCl được tạo thành sau 2 phút. Cho biết khối lượng (gam) của K cần thiết để tạo ra số mol KCl trên.
Lời giải:
a) Số mol CaCl2 được tạo ra sau 2 phút là:
Tốc độ trung bình của phản ứng (1) là:
(mol phút-1)
b) Số mol KCl được tạo thành sau 2 phút là:
nKCl = 0,0135 × 2 × 2 = 0,054 (mol)
Khối lượng K cần thiết cho phản ứng xảy ra là:
0,054 × 39 = 2,106 (gam).
Bài 16.5 trang 50 sách bài tập Hóa học 10: Cho hai phản ứng có phương trình hóa học như sau:
a) Viết biểu thức tốc độ trung bình (theo cả các chất phản ứng và chất sản phẩm) của hai phản ứng trên.
b) Trong phản ứng (1), nếu thì bằng bao nhiêu?
Lời giải:
a) Phản ứng (1):
Phản ứng (2):
b) Ta có:
A. Bằng
B. Bằng
C. Bằng
D. Bằng
Lời giải:
Đáp án đúng là: B
Tốc độ phản ứng bằng tốc độ mất đi của H2 và bằng tốc độ hình thành của NH3.
Bài 16.7 trang 50 sách bài tập Hóa học 10: Cho phản ứng:
6CH2O + 4NH3 → (CH2)6N4 + 6H2O
Tốc độ trung bình của phản ứng trên được biểu diễn bằng những biểu thức nào trong những biểu thức sau?
A.
B.
C.
D.
E.
Lời giải:
Đáp án đúng là: A, B, D
Bài 16.8 trang 51 sách bài tập Hóa học 10: Những phát biểu nào sau đây không đúng?
A. Phản ứng đơn giản là phản ứng xảy ra theo một bước.
B. Phản ứng đơn giản là phản ứng có các hệ số tỉ lượng trong phương trình hóa học bằng nhau và bằng 1.
C. Tốc độ của một phản ứng đơn giản tuân theo định luật tác dụng khối lượng.
D. Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
E. Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
G. Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
H. Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Lời giải:
Đáp án đúng là: B, D, E, G
Phát biểu B không đúng vì: Phản ứng đơn giản là phản ứng chỉ diễn ra qua một giai đoạn duy nhất, chất phản ứng tạo thành sản phẩm không qua một chất trung gian nào khác.
Phát biểu D không đúng vì: Định luật tác dụng khối lượng áp dụng cho các phản ứng đơn giản.
Phát biểu E không đúng vì: Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Phát biểu G không đúng vì: Hằng số tốc độ phản ứng phụ thuộc vào nhiệt độ và bản chất của các chất tham gia phản ứng.
Bài 16.9 trang 51 sách bài tập Hóa học 10: Cho phản ứng đơn giản:
H2 + I2 → 2HI
Người ta thực hiện ba thí nghiệm với nồng độ các chất đầu ( và ) được lấy khác nhau và xác định được tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
Biểu thức định luật tác dụng viết cho phản ứng trên là:
A. ? =
B. ? =
C. ? =
D. ? =
Lời giải:
Đáp án đúng là: B
Tốc độ chung của phản ứng = tốc độ tạo thành HI.
nên biểu thức định luật tác dụng khối lượng là: ? =
Bài 16.10 trang 51 sách bài tập Hóa học 10: Cho phản ứng:
2A + B → 2M + 3N
a) Hãy viết biểu thức tính tốc độ trung bình của phản ứng trên theo sự thay đổi nồng độ chất A, B, M và N.
b) Nếu biến thiên nồng độ trung bình của chất M là 1,0 mol L-1 s-1 thì tốc độ trung bình của phản ứng và biến thiên nồng độ trung bình của N ; A và B lần lượt là:
A. 2,0 mol L-1 s-1; 4,0 mol L-1 s-1; 6,0 mol L-1 s-1 và 2,0 mol L-1 s-1.
B. 0,5 mol L-1 s-1; 1,5 mol L-1 s-1; 1,0 mol L-1 s-1 và 0,5 mol L-1 s-1.
C. 1,0 mol L-1 s-1; 1,0 mol L-1 s-1; 1,0 mol L-1 s-1 và 1,0 mol L-1 s-1.
D. 2,0 mol L-1 s-1; 4,0 mol L-1 s-1; 3,0 mol L-1 s-1 và 2,0 mol L-1 s-1.
Lời giải:
a) Biểu thức tính tốc độ trung bình của phản ứng 2A + B → 2M + 3N theo sự thay đổi nồng độ chất A, B, M và N:
b) Đáp án đúng là: B
Tốc độ trung bình của phản ứng:
⇒ Loại A, C, D
Ngoài ra, tính cụ thể như sau:
a) Hãy tính sự thay đổi nồng độ chất B sau mỗi 10 giây từ 0,0 tới 40,0 giây. Các giá trị này tăng hay giảm khi đi từ khoảng thời gian này sang khoảng thời gian tiếp theo? Vì sao?
b) Tốc độ thay đổi của nồng độ chất A có liên quan như thế nào với tốc độ thay đổi của nồng độ chất B trong mỗi khoảng thời gian? Tính tốc độ thay đổi nồng độ của A trong khoảng thời gian từ 10 đến 20 giây.
Lời giải:
a) Sự thay đổi nồng độ chất B sau mỗi 10 giây từ 0,0 tới 40,0 giây:
Các giá trị này giảm dần do tốc độ phản ứng giảm dần (tốc độ phụ thuộc nồng độ chất phản ứng và theo thời gian nồng độ chất phản ứng giảm dần).
b) Tốc độ thay đổi của nồng độ chất A chỉ bằng một nửa tốc độ hình thành chất B do hệ số của hai chất trong phương trình.
Tốc độ thay đổi nồng độ của A trong khoảng thời gian từ 10,0 đến 20,0 giây là:
a) Cho biết khí thoát ra là khí gì. Hãy viết và cân bằng phương trình hoá học của phản ứng xảy ra.
b) Hoàn thành hai cột còn trống trong bảng trên. Hãy biểu diễn kết quả của hai bạn lên đồ thị thể tích khí thu được theo thời gian. Vì sao hai bạn lại lặp lại thí nghiệm ba lần?
c) Dựa vào đồ thị, cho biết khi nào phản ứng kết thúc. Vì sao?
d) Phản ứng diễn ra nhanh nhất trong khoảng thời gian nào? Sau đó, phản ứng diễn ra nhanh dần hay chậm dần?
e) Nếu thí nghiệm được lặp lại với nồng độ HCl lớn hơn thì tốc độ phản ứng sẽ nhanh hơn hay chậm hơn?
g) Nếu hai bạn không đo được thể tích khí thoát ra, em hãy đề xuất một cách khác để xác định tốc độ phản ứng.
Lời giải:
a) Khí thoát ra là khí H2.
Phương trình hóa học: Zn(s) + 2HCl(aq) → H2(g) + ZnCl2(aq)
b) Hoàn thành bảng:
Biểu diễn kết quả của hai bạn lên đồ thị thể tích khí thu được theo thời gian:
Hai bạn cần lặp lại thí nghiệm ba lần để giảm sai số trong quá trình thực nghiệm và tăng độ tin cậy của kết quả thu được.
c) Dựa vào đồ thị thấy khoảng 70 giây phản ứng sẽ kết thúc vì khi đó khí thoát ra rất chậm và gần như không đổi.
d) Dựa vào đồ thị xác định phản ứng nhanh nhất trong khoảng 10 giây đầu, sau đó chậm dần.
e) Nếu thí nghiệm được lặp lại với nồng độ HCl lớn hơn thì tốc độ phản ứng sẽ nhanh hơn.
g) Nếu hai bạn không đo được thể tích khí thoát ra, có thể thực hiện thí nghiệm bằng cách đặt bình phản ứng lên cân và theo dõi sự thay đổi khối lượng của bình phản ứng khi phản ứng diễn ra để tính khối lượng H2 thu được.
Lời giải:
Tốc độ của phản ứng ở 40 °C là:
Bài 16.14 trang 53 sách bài tập Hóa học 10: Một bạn học sinh thực hiện hai thí nghiệm:
Thí nghiệm 1: Cho 100 mL dung dịch acid HCl vào cốc (1), sau đó thêm một mẫu kẽm và đo tốc độ khí H2 thoát ra theo thời gian.
Thí nghiệm 2 (lặp lại tương tự thí nghiệm 1): 100 mL dung dịch acid HCl khác được cho vào cốc (2) rồi cũng thêm một mẫu kẽm vào và lại đo tốc độ khí hydrogen thoát ra theo thời gian.
Bạn học sinh đó nhận thấy tốc độ thoát khí hydrogen ở cốc (2) nhanh hơn ở cốc (1).
Những yếu tố nào sau đây có thể dùng để giải thích hiện tượng mà bạn đó quan sát được?
A. Phản ứng ở cốc (2) nhanh hơn nhờ có chất xúc tác.
B. Lượng kẽm ở cốc (1) nhiều hơn ở cốc (2).
C. Acid HCl ở cốc (1) có nồng độ thấp hơn acid ở cốc (2).
D. Kẽm ở cốc (2) được nghiền nhỏ còn kẽm ở cốc (1) ở dạng viên.
Lời giải:
Đáp án đúng là: B, C, D
Phát biểu A sai vì thí nghiệm không sử dụng chất xúc tác.
A. 2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)
B. 2H2(g) + O2(g) → 2H2O(l)
C. C(s) + O2(g) → CO2(g)
D. CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
Lời giải:
Đáp án đúng là: B, C
Áp suất ảnh hưởng đến tốc độ phản ứng có chất khí tham gia.
A. Khi đun nóng, bọt khí thoát ra nhanh hơn so với không đun nóng.
B. Khi đun nóng, bọt khí thoát ra chậm hơn so với không đun nóng.
C. Khi đun nóng, dây Mg tan nhanh hơn so với không đun nóng.
D. Khi đun nóng, dây Mg tan chậm hơn so với không đun nóng.
Lời giải:
Đáp án đúng là: A, C
Những mô tả phản ánh đúng hiện tượng quan sát được khi làm thí nghiệm:
A. Khi đun nóng, bọt khí thoát ra nhanh hơn so với không đun nóng.
C. Khi đun nóng, dây Mg tan nhanh hơn so với không đun nóng.
A. Tán nhỏ miếng đá vôi, cho vào dung dịch HCl 1M, không đun nóng.
B. Tán nhỏ miếng đá vôi, cho vào dung dịch HCl 1M, đun nóng.
C. Cho miếng đá vôi vào dung dịch HCl 1 M, không đun nóng.
D. Cho miếng đá vôi vào dung dịch HCl 1M, đun nóng.
Lời giải:
Đáp án đúng là: B
Thí nghiệm tiến hành trong điều kiện: Tán nhỏ miếng đá vôi, cho vào dung dịch HCl 1M, đun nóng sẽ thu được lượng CO2 lớn nhất.
Bài 16.18 trang 54 sách bài tập Hóa học 10: Chất xúc tác là chất
A. làm tăng tốc độ phản ứng và không bị mất đi sau phản ứng.
B. làm tăng tốc độ phản ứng và bị mất đi sau phản ứng.
C. làm giảm tốc độ phản ứng và không bị mất đi sau phản ứng.
D. làm giảm tốc độ phản ứng và bị mất đi sau phản ứng.
Lời giải:
Đáp án đúng là: A
Chất xúc tác là chất làm tăng tốc độ phản ứng và không bị mất đi sau phản ứng.
Lời giải:
Thời gian phân hủy (theo giây) khi phân huỷ cùng một lượng hydrogen peroxide đó, sử dụng enzyme catalase làm xúc tác là:
360 × 24 × 60 × 60 × 10-7 = 3,11 (giây).
1. Hoàn thành các câu sau đây nói về thí nghiệm của hai bạn.
a) Phương trình của phản ứng là: ......
b) Chất khí thoát ra là ...(1)... và có thể kiểm tra (nhận biết) ra nó bằng cách ...(2)...
c) Sau một thời gian nhất định, Vừng nói với Tôm là phản ứng đã kết thúc vì ......
d) Hai bạn biết rằng chất xúc tác chỉ làm tăng tốc độ phản ứng mà không thay đổi về bản chất hoá học nên Tôm sẽ thu lại manganese dioxide sau khi phản ứng kết thúc bằng cách .....
2. Tôm và Vừng muốn biết liệu cho lượng xúc tác nhiều hơn thì có làm phản ứng nhanh hơn không. Em hãy đề xuất một kế hoạch thí nghiệm cho nghiên cứu của hai bạn. Trong bản kế hoạch, em cần viết cả những lưu ý để đảm bảo an toàn khi làm việc trong phòng thí nghiệm.
Lời giải:
1.
a) Phương trình của phản ứng là: H2O2 + H2O
b) Chất khí thoát ra là (1) oxygen và có thể kiểm tra (nhận biết) ra nó bằng cách (2) đưa que đóm còn tàn đỏ sẽ thấy que đóm bùng cháy.
c) Sau một thời gian nhất định, Vừng nói với Tôm là phản ứng đã kết thúc vì không còn thấy khí thoát ra.
d) Hai bạn biết rằng chất xúc tác chỉ làm tăng tốc độ phản ứng mà không thay đổi về bản chất hoá học nên Tôm sẽ thu lại manganese dioxide sau khi phản ứng kết thúc bằng cách lọc.
2. Kế hoạch thí nghiệm:
Hóa chất: H2O2; MnO2
Dụng cụ: Bình tam giác to (hoặc lọ thủy tinh), ống dẫn khí, phễu brom, ống nghiệm, chậu thủy tinh.
Chú ý: Phễu brom là loại phễu được thiết kế có nút đậy, khóa nhám, Loại này được dùng để đựng và rót các loại hóa chất có dạng lỏng bay hơi xuống các bình, lọ trong lúc đang tiến hành các phản ứng hóa học.
Cách tiến hành:
Thí nghiệm 1: Cho một lượng H2O2 vào phễu brom, cho 1 gam MnO2 vào bình tam giác. Mở từ từ khóa phễu brom cho H2O2 chảy xuống; khí O2 được thu vào bình thu khí bằng phương pháp dời nước. Bấm giờ theo dõi thời gian từ lúc bắt đầu mở khóa phễu cho đến khi phản ứng kết thúc (ngừng sủi bọt khí).
Thí nghiệm 2: Cho một lượng H2O2 (bằng lượng dùng ở thí nghiệm 1) vào phễu brom, cho 2 gam MnO2 vào bình tam giác. Mở từ từ khóa phễu brom cho H2O2 chảy xuống; khí O2 được thu vào bình thu khí bằng phương pháp dời nước. Bấm giờ theo dõi thời gian từ lúc bắt đầu mở khóa phễu cho đến khi phản ứng kết thúc (ngừng sủi bọt khí).
So sánh thời gian phản ứng ở hai thí nghiệm, rút ra kết luận.
Lưu ý:
- Trước khi lắp dụng cụ thí nghiệm cần phác họa sơ đồ dụng cụ, thống kê các bộ phận cần thiết, chọn đủ dụng cụ rồi mới lắp.
- Sau khi lắp xong dụng cụ thí nghiệm cần thử lại xem dụng cụ đã kín chưa. Ví dụ: Dùng miệng thổi hoặc nhỏ nước lên chỗ nối để kiểm tra.
- Sau mỗi lần lấy H2O2 phải đóng kín lại ngay.
Xem thêm các bài giải SBT Hoá học lớp 10 Cánh diều hay, chi tiết khác:
Bài 14: Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài 16: Tốc độ phản ứng hóa học
Bài 17: Nguyên tố và đơn chất halogen
Bài 18: Hydrogen halide và hydrohalic acid
Lý thuyết Tốc độ phản ứng hóa học
I. Khái niệm tốc độ phản ứng, tốc độ trung bình của phản ứng
1. Khái niệm tốc độ phản ứng
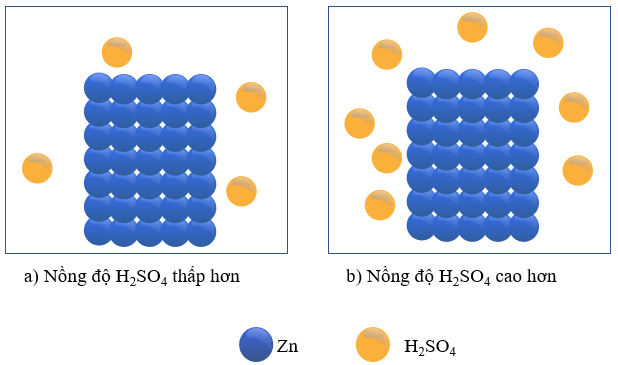
- Thí nghiệm: Cho hai mảnh Zn có cùng khối lượng vào hai bình chứa cùng thể tích dung dịch H2SO4 loãng, dư, nồng độ dung dịch ở mỗi bình lần lượt là 0,5M và 1M.

Hình 16.1. Thí nghiệm Zn tác dụng với H2SO4 loãng
+ Phản ứng xảy ra trong thí nghiệm cho Zn vào dung dịch H2SO4 loãng, ở hai nồng độ khác nhau như sau:
Zn(s) + H2SO4(aq) ZnSO4(aq) + H2(g)
+ Hiện tượng: bọt khí H2 thoát ra ở thí nghiệm (b) nhanh hơn so với thí nghiệm (a) đã chứng tỏ lượng H2SO4 bị mất đi do phản ứng với Zn ở thí nghiệm (b) nhanh hơn ở thí nghiệm (a).
Tốc độ phản ứng giữa Zn với dung dịch H2SO4 ở các nồng độ khác nhau là khác nhau.
+ Trong hai thí nghiệm trên, coi thể tích của dung dịch là không đổi trong suốt quá trình phản ứng. Trong cùng một khoảng thời gian, độ giảm nồng độ H2SO4 trong thí nghiệm (b) là nhanh hơn so với trong thí nghiệm (a).
Có thể dựa theo sự thay đổi nồng độ của chất trong phản ứng trong một đơn vị thời gian để đánh giá mức độ nhanh, chậm của phản ứng.
Kết luận:
- Khái niệm: Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
- Tốc độ phản ứng được kí hiệu là v, có đơn vị là (đơn vị nồng độ) (đơn vị thời gian)-1
Ví dụ: mol L-1 s-1 (hay M s-1), ...
2. Tốc độ trung bình của phản ứng
- Tốc độ trung bình của phản ứng (![]() ) là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
) là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
- Cho phản ứng tổng quát:
aA + bB mM + nN (1)
Tốc độ phản ứng (1) được tính dựa theo sự thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước sau:
![]() (2)
(2)
Trong đó: ΔC = C2 – C1, Δt = t2 – t1 lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng. C1, C2 là nồng độ của một chất tại thời điểm tương ứng t1 và t2 (với t2 > t1).
Ví dụ: Cho phản ứng phân hủy N2O5:
2N2O5(g) 4NO2(g) + O2(g) (3)
Nồng độ của mỗi chất trong phản ứng (3) tại thời điểm t1 = 0 và t2 = 50s được cho trong bảng sau:
Bảng 16.1. Dữ liệu nồng độ các chất (mol L-1)
Tốc độ trung bình của phản ứng (3) có thể được tính theo biến thiên nồng độ chất phản ứng hoặc sản phẩm:
+ Tính theo nồng độ N2O5
Nồng độ của N2O5 ban đầu (C1) là 0,0200M, sau 50 s (C2) là 0,0045M
Vậy tốc độ trung bình của phản ứng trong 50s đầu tiên là:
![]() = 1,55,10-5 (M s-1)
= 1,55,10-5 (M s-1)
+ Tính theo O2
Nồng độ của O2 ban đầu (C1) là 0M, sau 50 s (C2) là 0,000775M
Vậy tốc độ trung bình của phản ứng trong 50s đầu tiên là:
= 1,55,10-5 (M s-1)
II. Định luật tác dụng khối lượng
- Thí nghiệm: Cho hai mảnh Zn có cùng khối lượng vào hai bình chứa cùng thể tích dung dịch H2SO4 loãng, dư, nồng độ dung dịch ở mỗi bình lần lượt là 0,5M và 1M.
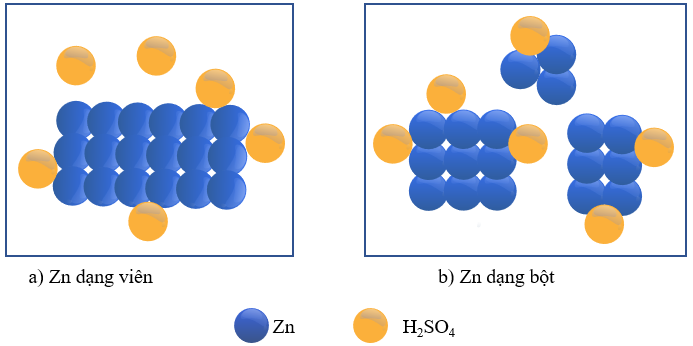
Hình 16.2. Minh họa mô hình Zn trong dung dịch H2SO4 loãng
- Giải thích: Để phản ứng xảy ra, cần phải có sự va chạm giữa H2SO4 và Zn. Nồng độ của H2SO4 ở bình (b) lớn gấp đôi nồng độ H2SO4 ở bình (a), do vậy số va chạm của H2SO4 với Zn trong bình (b) sẽ nhiều hơn, dẫn đến tốc độ phản ứng ở bình (b) là lớn hơn.
- Kết luận: Khi nồng độ các chất tham gia phản ứng càng lớn thì tốc độ phản ứng càng lớn.
- Giải thích: Để phản ứng xảy ra, các phân tử phản ứng phải va chạm với nhau, nồng độ càng lớn thì số lượng va chạm càng nhiều (trong cùng một đơn vị thời gian, một đơn vị thể tích) nên tốc độ phản ứng càng lớn.
- Định luật tác dụng khối lượng áp dụng cho các phản ứng đơn giản, biểu thị sự phụ thuộc tốc độ phản ứng theo nồng độ các chất phản ứng.
Lưu ý: Phản ứng đơn giản là phản ứng chỉ diễn ra qua một giai đoạn duy nhất, chất phản ứng tạo thành sản phẩm không qua một chất trung gian nào khác.
- Cho phản ứng tổng quát: aA + bB sản phẩm
+ Tốc độ phản ứng được tính như sau: v = k(4)
+ Trong đó: CA, CB là nồng độ mol. L-1 tương ứng của chất A và B; k là hằng số tốc độ phản ứng mà giá trị của nó chỉ phụ thuộc vào nhiệt độ và bản chất các chất tham gia phản ứng.
- Định luật tác dụng khối lượng: Tốc độ phản ứng tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
® Hằng số tốc độ phản ứng càng lớn thì tốc độ phản ứng càng lớn.
- Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1M. Đây chính là ý nghĩa của hằng số tốc độ phản ứng.
Ví dụ: Phản ứng của N2 và H2 là phản ứng đơn giản:
N2(g) + 3H2(g) 2NH3(g) (5)
+ Theo định luật tác dụng khối lượng, tốc độ của phản ứng (5) được viết dưới dạng:
v = k
+ Ở một nhiệt độ không đổi, tốc độ phản ứng (5) tỉ lệ với nồng độ N2 và H2.
Lưu ý: Tốc độ phản ứng tính theo định luật tác dụng khối lượng là tốc độ tức thời của phản ứng tại một thời điểm, khác với tốc độ trung bình của phản ứng trong một khoảng thời gian như đã nêu trên.
III. Các yếu tố ảnh hưởng tới tốc độ phản ứng, hệ số nhiệt độ Van’t Hoff
1. Ảnh hưởng của nồng độ
- Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn.
Ví dụ: Phản ứng của H2 và I2 như sau:
H2(g) + I2(g) 2HI(g) (6)
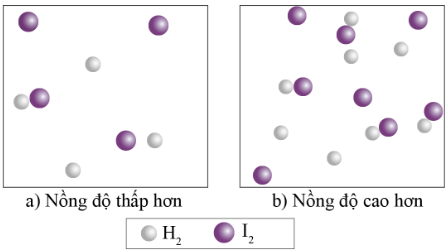
Hình 16.3. Ảnh hưởng của nồng độ các chất phản ứng tới tốc độ phản ứng
+ Giải thích: Khi nồng độ của H2 và I2 tăng lên trong một đơn vị thể tích, các phân tử này cũng sẽ nhiều hơn, dẫn đến số lượng va chạm giữa chúng (trong cùng một đơn vị thời gian) tăng lên. Vì vậy tốc độ phản ứng tăng lên khi nồng độ các chất tăng.
2. Ảnh hưởng của áp suất
- Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng càng lớn.
- Giải thích: Đối với các chất khí, nồng độ của chất khí tỉ lệ với áp suất của nó. Do vậy, khi áp suất chất tham gia phản ứng ở thể khí tăng lên, sẽ làm nồng độ chất khí tăng lên, từ đó làm tốc độ phản ứng tăng.
Ví dụ: Phản ứng tổng hợp NH3 từ N2 và H2 được thực hiện ở áp suất rất cao từ 200 – 300 atm để tăng tốc độ phản ứng.
3. Ảnh hưởng của diện tích bề mặt
- Thí nghiệm: Dùng hai mẫu Zn có cùng khối lượng, trong đó một mẫu dạng hạt còn một mẫu dạng bột. Cho hai mẫu đó cùng tác dụng với hai thể tích bằng nhau dung dịch H2SO4 loãng, dư, cùng nồng độ.
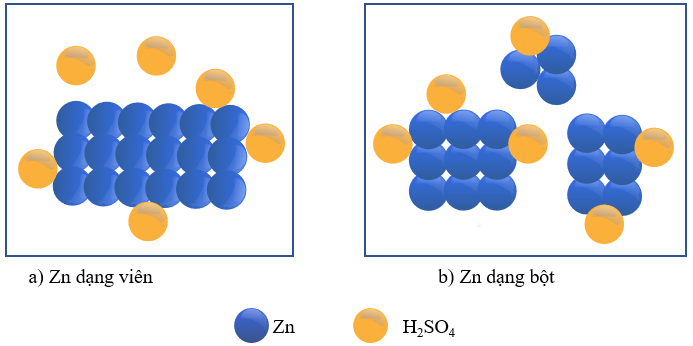
Hình 16.4. Ảnh hưởng của diện tích bề mặt tới tốc độ phản ứng
- Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn.
- Giải thích: Khi diện tích bề mặt tăng lên, dẫn đến số lượng va chạm giữa các chất phản ứng tăng lên (trong cùng một đơn vị thời gian) tăng lên. Vì vậy tốc độ phản ứng tăng lên khi nồng độ các chất tăng.
- Ảnh hưởng của diện tích bề mặt tới tốc độ phản ứng trong thực tế: thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn, than tổ ong có nhiều lỗ sẽ cháy nhanh hơn, ...
4. Ảnh hưởng của nhiệt độ
- Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị g = 2 ÷ 4 này được gọi là hệ số nhiệt độ Van’t Hoff.
- Mối liên hệ của hệ số nhiệt độ Van’t Hoff tới tốc độ và nhiệt độ như sau:
Trong đó, v2 và v1 là tốc độ phản ứng ở nhiệt độ T2 và T1 tương ứng.
- Ảnh hưởng của nhiệt độ tới tốc độ phản ứng trong thực tế: Nước nhanh sôi hơn khi được đun ở nhiệt độ cao; thức ăn bị chậm ôi, thiu khi được để trong tủ lạnh, ...
5. Ảnh hưởng của chất xúc tác
- Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị thay đổi cả về lượng và chất sau phản ứng.
Ví dụ 1: Khi đun nóng, KClO3 bị phân hủy tương đối chậm theo phương trình:
3KClO3(s) 3KCl(s) + 3O2(g)
Tuy nhiên tốc độ phản ứng phân hủy này sẽ nhanh hơn rất nhiều khi có mặt chất xúc tác MnO2. Kết thúc thí nghiệm trên, màu đen của MnO2 ban đầu vẫn giữ nguyên vì MnO2 không bị biến đổi sau phản ứng phân hủy KClO3.
- Ảnh hưởng của nhiệt độ tới tốc độ phản ứng trong thực tế:
+ Phản ứng tổng hợp NH3 từ N2 và H2 cần sử dụng chất xúc tác là sắt kim loại được trộn thêm Al2O3, K2O, ... để làm tăng tốc độ phản ứng, phản ứng không có chất xúc tác sẽ diễn ra rất chậm.
+ Các enzyme trong cơ thể là những chất xúc tác sinh học thúc đẩy các phản ứng sinh hóa phức tạp trong cơ thể chúng ta. Ví dụ enzyme amylase có trong nước ngọt giúp thủy phân tinh bột thành đường.