Với giải Câu hỏi 2 trang 89 Hóa học lớp 10 Cánh diều chi tiết trong Bài 16: Tốc độ phản ứng hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 16: Tốc độ phản ứng hóa học
Câu hỏi 2 trang 89 Hóa học 10: Tốc độ của phản ứng (1) ở dung dịch HCl 2M là nhanh hơn hay chậm hơn so với ở dung dịch HCl 0,5M?
Phương pháp giải:
Bong bóng khí H2 thoát ra nhanh hơn ở thí nghiệm với dung dịch HCl 2M so với thí nghiệm sử dụng dung dịch HCl 0,5M
=> HCl (trong dung dịch 2M ban đầu) bị mất đi do phản ứng với Mg nhanh hơn lượng HCl (trong dung dịch 0,5M ban đầu) mất đi do phản ứng với Mg
Lời giải:
- Vì nồng độ dung dịch MgCl2 ở dung dịch chứa HCl 2M tăng lên nhanh hơn
=> Tốc độ của phản ứng (1) ở dung dịch HCl 2M nhanh hơn so với ở dung dịch HCl 0,5M
Lý thuyết Khái niệm tốc độ phản ứng, tốc độ trung bình của phản ứng
1. Khái niệm tốc độ phản ứng
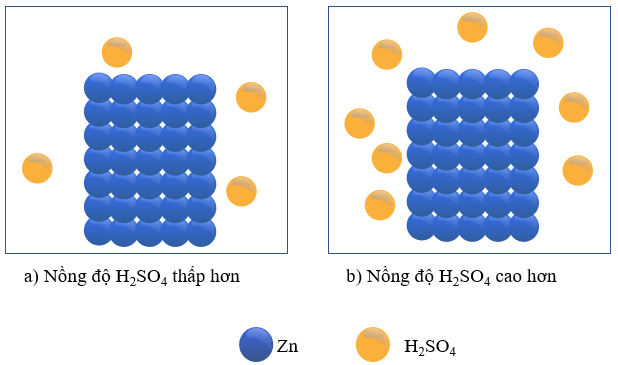
- Thí nghiệm: Cho hai mảnh Zn có cùng khối lượng vào hai bình chứa cùng thể tích dung dịch H2SO4 loãng, dư, nồng độ dung dịch ở mỗi bình lần lượt là 0,5M và 1M.

Hình 16.1. Thí nghiệm Zn tác dụng với H2SO4 loãng
+ Phản ứng xảy ra trong thí nghiệm cho Zn vào dung dịch H2SO4 loãng, ở hai nồng độ khác nhau như sau:
Zn(s) + H2SO4(aq) ZnSO4(aq) + H2(g)
+ Hiện tượng: bọt khí H2 thoát ra ở thí nghiệm (b) nhanh hơn so với thí nghiệm (a) đã chứng tỏ lượng H2SO4 bị mất đi do phản ứng với Zn ở thí nghiệm (b) nhanh hơn ở thí nghiệm (a).
Tốc độ phản ứng giữa Zn với dung dịch H2SO4 ở các nồng độ khác nhau là khác nhau.
+ Trong hai thí nghiệm trên, coi thể tích của dung dịch là không đổi trong suốt quá trình phản ứng. Trong cùng một khoảng thời gian, độ giảm nồng độ H2SO4 trong thí nghiệm (b) là nhanh hơn so với trong thí nghiệm (a).
Có thể dựa theo sự thay đổi nồng độ của chất trong phản ứng trong một đơn vị thời gian để đánh giá mức độ nhanh, chậm của phản ứng.
Kết luận:
- Khái niệm: Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
- Tốc độ phản ứng được kí hiệu là v, có đơn vị là (đơn vị nồng độ) (đơn vị thời gian)-1
Ví dụ: mol L-1 s-1 (hay M s-1), ...
2. Tốc độ trung bình của phản ứng
- Tốc độ trung bình của phản ứng (![]() ) là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
) là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
- Cho phản ứng tổng quát:
aA + bB mM + nN (1)
Tốc độ phản ứng (1) được tính dựa theo sự thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước sau:
![]() (2)
(2)
Trong đó: ΔC = C2 – C1, Δt = t2 – t1 lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng. C1, C2 là nồng độ của một chất tại thời điểm tương ứng t1 và t2 (với t2 > t1).
Ví dụ: Cho phản ứng phân hủy N2O5:
2N2O5(g) 4NO2(g) + O2(g) (3)
Nồng độ của mỗi chất trong phản ứng (3) tại thời điểm t1 = 0 và t2 = 50s được cho trong bảng sau:
Bảng 16.1. Dữ liệu nồng độ các chất (mol L-1)
Tốc độ trung bình của phản ứng (3) có thể được tính theo biến thiên nồng độ chất phản ứng hoặc sản phẩm:
+ Tính theo nồng độ N2O5
Nồng độ của N2O5 ban đầu (C1) là 0,0200M, sau 50 s (C2) là 0,0045M
Vậy tốc độ trung bình của phản ứng trong 50s đầu tiên là:
![]() = 1,55,10-5 (M s-1)
= 1,55,10-5 (M s-1)
+ Tính theo O2
Nồng độ của O2 ban đầu (C1) là 0M, sau 50 s (C2) là 0,000775M
Vậy tốc độ trung bình của phản ứng trong 50s đầu tiên là:
= 1,55,10-5 (M s-1)
Xem thêm lời giải bài tập Hóa Học 10 Cánh diều hay, chi tiết khác:
Vận dụng 3 trang 93 Hóa học 10: Hãy giải thích các hiện tượng dưới đây....
Vận dụng 4 trang 94 Hóa học 10: Giải thích vì sao thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 14 : Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài 16: Tốc độ phản ứng hóa học
Bài 17: Nguyên tố và đơn chất halogen
Bài 18: Hydrogen halide và hydrohalic acid