Với giải Vận dụng 2 trang 34 Hóa học lớp 10 Cánh diều chi tiết trong Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Vận dụng 2 trang 34 Hóa học 10: Nguyên tố được bổ sung vào muối ăn để giảm nguy cơ bướu cổ thuộc chu kì nào trong bảng tuần hoàn?
Phương pháp giải:
Nguyên tố được bổ sung vào muối ăn là iodua ⟹ Xác định iodua ở ô số mấy trong bảng tuần hoàn.
Lời giải chi tiết:
Nguyên tố được bổ sung vào muối ăn là iodua, iodua nằm ở ô số 53 trong bảng tuần hoàn.
Lý thuyết Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bảng tuần hoàn các nguyên tố hóa học hiện nay (gọi tắt là bảng tuần hoàn) gồm 118 nguyên tố hóa học. Vị trí của mỗi nguyên tố hóa học trong bảng tuần hoàn được thể hiện qua số thứ tự ô nguyên tố, chu kì và nhóm.
1. Ô nguyên tố
- Mỗi nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn, gọi là ô nguyên tố.
- Mỗi ô chứa một số thông tin của một nguyên tố hóa học như: kí hiệu hóa học, tên nguyên tố, số hiệu nguyên tử và nguyên tử khối trung bình, ...
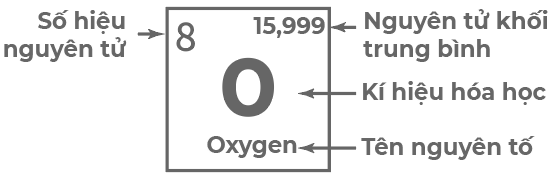
Hình 6.2. Các thông tin cơ bản trong một ô nguyên tố hóa học
- Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
Ví dụ: Nguyên tử O có số hiệu nguyên tử là 8 nên O nằm ở ô số 8 trong bảng tuần hoàn.
2. Chu kì
- Chu kì là tập hợp các nguyên tố hóa học mà nguyên tử của chúng có cùng số lớp electron, được xếp thành hàng theo chiều tăng dần điện tích hạt nhân từ trái sang phải.

Hình 6.3. Các chu kì nhỏ trong bảng tuần hoàn nguyên tố hóa học
- Bảng tuần hoàn gồm 7 chu kì, được đánh số từ 1 đến 7.
- Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của các nguyên tố thuộc chu kì đó.
Ví dụ: Nguyên tử của nguyên tố O có 2 lớp electron nên O thuộc chu kì 2 của bảng tuần hoàn.
3. Nhóm
- Nhóm là tập hợp các nguyên tố hóa học mà nguyên tử có cấu hình electron tương tự nhau, được xếp thành cột theo chiều tăng dần điện tích hạt nhân từ trên xuống dưới.
- Các nguyên tố được chia thành nguyên tố nhóm A và nguyên tố nhóm B dựa theo sự khác nhau về đặc điểm cấu hình electron.
- Nguyên tử của các nguyên tố trong cùng một nhóm A (hoặc nhóm B) có cấu hình electron tương tự nhau nên có tính chất hóa học tương tự nhau.
- Bảng tuần hoàn gồm 18 cột, được chia thành 8 nhóm A, đánh số từ IA đến VIIIA; 8 nhóm B, được đánh số từ IB đến VIIIB. Mỗi nhóm A hay B đều chỉ có một cột, trừ nhóm VIIIB có ba cột.

Hình 6.4. Một số nhóm nguyên tố trong bảng tuần hoàn
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Câu hỏi 4 trang 34 Hóa học 10: Hãy cho biết những thông tin thu được từ ô nguyên tố Vanadium...
Vận dụng 3 trang 37 Hóa học 10: Hãy thu thập thông tin về các vấn đề sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 5: Lớp, phân lớp và cấu hình electron
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học