Với giải Luyện tập 1 trang 32 Hóa học lớp 10 Cánh diều chi tiết trong Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Luyện tập 1 trang 32 Hóa học 10: Trong hình 6.1, Mendeleev có ghi: Au = 197? và Bi = 210?. Theo em, ý nghĩa của dấu hỏi chấm ở đây là gì?

Lời giải:
- Các dấu ? được Mendeleev ghi trong bảng tuần hoàn các nguyên tố hóa học năm 1896 là các dự đoán của ông, chưa chắc chắn các thông tin đó chính xác chưa.
- Hoặc dấu ? biểu thị cho các nguyên tố hóa học còn thiếu.
Lý thuyết Lịch sử phát minh
- D. I. Mendeleev (1834 – 1907), một nhà Hóa học người Nga, được coi là cha đẻ của bảng tuần hoàn các nguyên tố hóa học.
- Mendeleev nhận thấy có mối liên hệ giữa khối lượng nguyên tử và tính chất các nguyên tố tương ứng qua dãy một số nguyên tố có tính chất tương tự nhau: dãy halogen (Cl, Br, I), kim loại kiềm (K, Rb, Cs), kim loại kiềm thổ (Ca, Sr, Ba). Ông sắp xếp chúng vào một bảng với khối lượng nguyên tử tương ứng như sau:
Bảng 6.1. Cách sắp xếp 9 nguyên tố hóa học theo khối lượng nguyên tử của Mendeleev
|
Cl = 35,5 |
Br = 80 |
I = 127 |
|
K = 39 |
Rb = 85,4 |
Cs = 133 |
|
Ca = 40 |
Sr = 87,6 |
Ba = 137 |
- Sau đó bằng cách thêm các nguyên tố khác theo mô hình này Mendeleev đã công bố phiên bản mở rộng của bảng tuần hoàn vào năm 1869, bao gồm tất cả các nguyên tố đã biết, cũng như dự đoán nhiều nguyên tố mới. Ông cho rằng “Nếu các nguyên tố được sắp xếp theo thứ tự tăng dần khối lượng nguyên tử, sẽ xuất hiện sự tuần hoàn về các tính chất của chúng”.
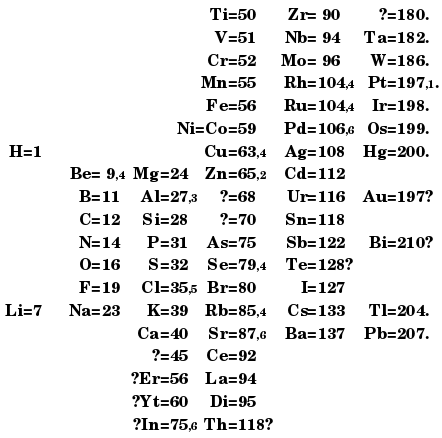
Hình 6.1. Bảng tuần hoàn các nguyên tố hóa học của Mendeleev năm 1869
- Năm 1871, Mendeleev đã đưa ra định luật tuần hoàn “Tính chất của các đơn chất, cấu tạo và tính chất các hợp chất của chúng có tính tuần hoàn theo khối lượng nguyên tử của các nguyên tố”. Nhờ định luật này, Mendeleev đã dự đoán tới 10 nguyên tố mới, trong đó có 3 nguyên tố được tiên đoán khá tỉ mỉ về tính chất của đơn chất và hợp chất của chúng (các nguyên tố Se, Ga và Ge).
- Bảng tuần hoàn các nguyên tố hóa học hiện đại ngày nay được xây dựng trên cơ sở sử dụng mối liên hệ “số hiệu nguyên tử - tính chất” thay vì mối liên hệ “khối lượng nguyên tử - tính chất”. Cách xây dựng này không những giúp nhanh chóng so sánh, suy luận về tính chất của đơn chất và hợp chất, mà còn cung cấp thông tin phong phú về mỗi nguyên tố hóa học.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Câu hỏi 4 trang 34 Hóa học 10: Hãy cho biết những thông tin thu được từ ô nguyên tố Vanadium...
Vận dụng 3 trang 37 Hóa học 10: Hãy thu thập thông tin về các vấn đề sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 5: Lớp, phân lớp và cấu hình electron
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học