Với giải Câu hỏi 3 trang 55 Hóa học lớp 10 Chân trời sáng tạo chi tiết tron Bài 9: Liên kết ion giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 9: Liên kết ion
Câu hỏi 3 trang 55 Hóa học 10: Ion Na+ và ion O2- thu được có bền vững về mặt hóa học không? Chúng có cấu hình electron giống cấu hình electron nguyên tử của nguyên tố nào?
Phương pháp giải:
Nguyên tố, ion có cấu hình electron giống của khí hiếm => bền vững về mặt hóa học
Lời giải:
- Ion Na+ có 10 electron ở lớp vỏ và có 2 lớp electron => Giống cấu hình electron nguyên tử của nguyên tố Ne => Bền vững về mặt hóa học
- Ion O2- có 10 electron ở lớp vỏ và có 2 lớp electron => Giống cấu hình electron nguyên tử của nguyên tố Ne => Bền vững về mặt hóa học
Lý thuyết Ion và sự hình thành liên kết ion
1. Sự tạo thành ion
- Khi nhường electron, nguyên tử trở thành ion dương (cation)
Ví dụ:
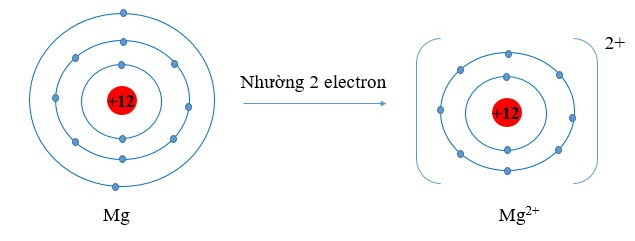
Viết gọn: Mg → Mg2+ + 2e
- Khi nhận electron, nguyên tử trở thành ion âm (anion)
Ví dụ:
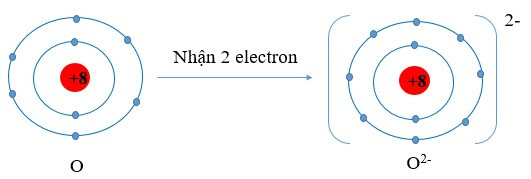
Viết gọn: O + 2e → O2-
Chú ý: Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tưr nhường hoặc nhận.
2. Liên kết ion
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
- Ví dụ: Sự hình thành liên kết ion trong phân từ sodium chloride:
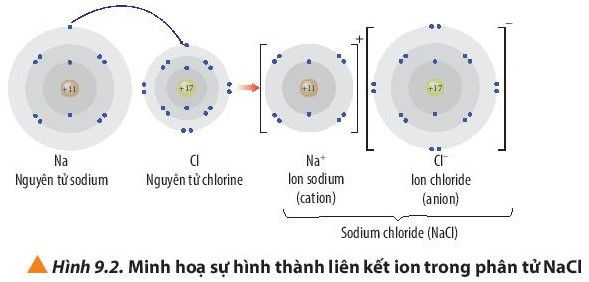
+ Nguyên tử Na (Z = 11) nhường đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+.
+ Nguyên tử Cl (Z = 17) nhận 1 electron từ nguyên tử Na trở thành ion mang điện tích âm, kí hiệu là Cl-.
Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử NaCl.
Phương trình hóa học: 2Na + Cl2 → 2NaCl.
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 7 trang 56 Hóa học 10: Quan sát Hình 9.3, cho biết:...
Câu hỏi 8 trang 56 Hóa học 10: Em hiểu thế nào về tinh thể ion?...
Bài 4 trang 58 Hóa học 10: Hoàn thành những thông tin còn thiếu trong bảng sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: