Với giải Bài 1 trang 58 Hóa học lớp 10 Chân trời sáng tạo chi tiết tron Bài 9: Liên kết ion giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 9: Liên kết ion
Bài 1 trang 58 Hóa học 10: Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
Phương pháp giải:
- Viết cấu hình của Mg => Cấu hình electron của Mg2+
Lời giải:
Nguyên tử Mg (Z = 12): 1s22s22p63s2
=> Mg2+: 1s22s22p6 => Ion Mg2+ có 10 electron và 2 lớp electron
=> Giống cấu hình electron của nguyên tử khí hiếm Neon
Đáp án B
Bài tập vận dụng:
Câu 1. Quá trình hình thành liên kết ion trong phân tử CaCl2 là
A. Ca ⟶ Ca2+ + 2e; Cl + 2e ⟶ Cl2−; Ca2+ + Cl2−⟶ CaCl2
B. Ca ⟶ Ca2+ + 2e; Cl + 1e ⟶ Cl−; Ca2+ + Cl−⟶ CaCl2
C. Ca ⟶ Ca2+ + 2e; Cl + 1e ⟶ Cl−; Ca2+ + 2Cl−⟶ CaCl2
D. Ca ⟶ Ca+ + 1e; Cl + 2e ⟶ Cl2−; Ca+ + Cl2−⟶ CaCl2
Đáp án đúng là: C
Ca (Z = 20): [Ar]4s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Cl (Z = 17): [Ne]3s23p5 có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Quá trình hình thành liên kết ion:
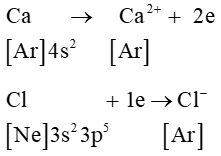
Ca2+ + 2Cl−⟶ CaCl2
Câu 2. Ion Al3+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
Đáp án đúng là: B
Al (Z = 13): [Ne]3s23p1 có 3 electron lớp ngoài cùng ⇒ xu hướng nhường 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
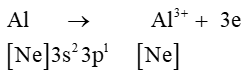
Câu 3. Cho các ion sau: Ca2+, F-, Al3+ và P3−. Số ion có cấu hình electron của khí hiếm neon là
A. 4
B. 2
C. 1
D. 3
Đáp án đúng là: B
Ca (Z = 20): [Ar]4s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ar.
⇒ Cấu hình electron của Ca2+ là: [Ar]
F (Z = 9): 1s22s22p5 có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
⇒ Cấu hình electron của F− là: [Ne]
Al (Z = 13): [Ne]3s23p1 có 3 electron lớp ngoài cùng ⇒ xu hướng nhường 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
⇒ Cấu hình electron của Al3+ là: [Ne]
P (Z = 15): [Ne]3s23p3 có 5 electron lớp ngoài cùng ⇒ xu hướng nhận 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ar.
⇒ Cấu hình electron của P3− là: [Ar]
Vậy có 2 ion có cấu hình electron của khí hiếm neon.
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 7 trang 56 Hóa học 10: Quan sát Hình 9.3, cho biết:...
Câu hỏi 8 trang 56 Hóa học 10: Em hiểu thế nào về tinh thể ion?...
Bài 4 trang 58 Hóa học 10: Hoàn thành những thông tin còn thiếu trong bảng sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: