Với giải Bài 5 trang 58 Hóa học lớp 10 Chân trời sáng tạo chi tiết tron Bài 9: Liên kết ion giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 9: Liên kết ion
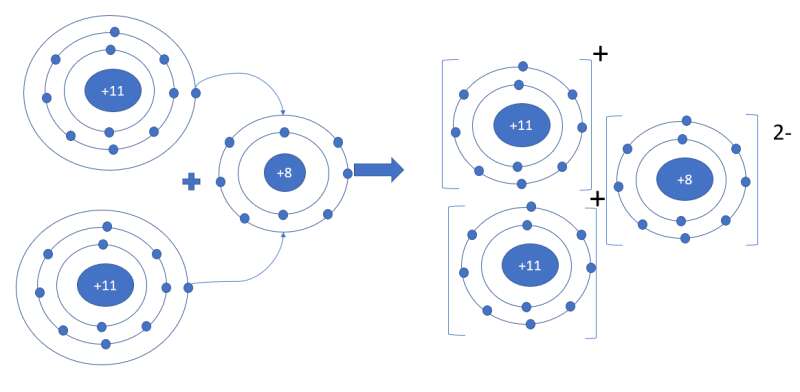
Bài 5 trang 58 Hóa học 10: Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Trình bày sự hình thành liên kết ion trong phân tử sodium oxide
Phương pháp giải:
- Viết cấu hình của nguyên tử Na => Xu hướng nhận hay nhường bao nhiêu electron
- Viết cấu hình của nguyên tử O => Xu hướng nhận hay nhường bao nhiêu electron
Lời giải:
- Nguyên tử Na (Z = 11): 1s22s22p63s1 => Xu hướng nhường 1 electron tạo thành ion Na+
- Nguyên tử O (Z = 8): 1s22s22p4 => Xu hướng nhận 2 electron tạo thành ion O2-
=> Mỗi nguyên tử Na sẽ nhường 1 electron cho nguyên tử O để tạo thành 2 ion Na+ và 1 ion O2-. 3 ion này liên kết với nhau tạo thành phân tử Na2O
Bài tập vận dụng:
Câu 1. Quá trình hình thành liên kết ion trong phân tử CaCl2 là
A. Ca ⟶ Ca2+ + 2e; Cl + 2e ⟶ Cl2−; Ca2+ + Cl2−⟶ CaCl2
B. Ca ⟶ Ca2+ + 2e; Cl + 1e ⟶ Cl−; Ca2+ + Cl−⟶ CaCl2
C. Ca ⟶ Ca2+ + 2e; Cl + 1e ⟶ Cl−; Ca2+ + 2Cl−⟶ CaCl2
D. Ca ⟶ Ca+ + 1e; Cl + 2e ⟶ Cl2−; Ca+ + Cl2−⟶ CaCl2
Đáp án đúng là: C
Ca (Z = 20): [Ar]4s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Cl (Z = 17): [Ne]3s23p5 có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Quá trình hình thành liên kết ion:
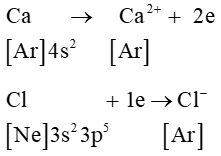
Ca2+ + 2Cl−⟶ CaCl2
Câu 2. Ion Al3+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
Đáp án đúng là: B
Al (Z = 13): [Ne]3s23p1 có 3 electron lớp ngoài cùng ⇒ xu hướng nhường 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
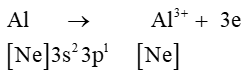
Câu 3. Cho các ion sau: Ca2+, F-, Al3+ và P3−. Số ion có cấu hình electron của khí hiếm neon là
A. 4
B. 2
C. 1
D. 3
Đáp án đúng là: B
Ca (Z = 20): [Ar]4s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ar.
⇒ Cấu hình electron của Ca2+ là: [Ar]
F (Z = 9): 1s22s22p5 có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
⇒ Cấu hình electron của F− là: [Ne]
Al (Z = 13): [Ne]3s23p1 có 3 electron lớp ngoài cùng ⇒ xu hướng nhường 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
⇒ Cấu hình electron của Al3+ là: [Ne]
P (Z = 15): [Ne]3s23p3 có 5 electron lớp ngoài cùng ⇒ xu hướng nhận 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ar.
⇒ Cấu hình electron của P3− là: [Ar]
Vậy có 2 ion có cấu hình electron của khí hiếm neon.
Bài giảng Hóa học 10 Bài 9: Liên kết ion - Chân trời sáng tạo
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 7 trang 56 Hóa học 10: Quan sát Hình 9.3, cho biết:...
Câu hỏi 8 trang 56 Hóa học 10: Em hiểu thế nào về tinh thể ion?...
Bài 4 trang 58 Hóa học 10: Hoàn thành những thông tin còn thiếu trong bảng sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: