Với tóm tắt lý thuyết Hóa học lớp 12 Bài 15: Tách kim loại và tái chế kim loại sách Cánh diều hay, chi tiết cùng với 10 bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa học 12 Bài 15: Tách kim loại và tái chế kim loại
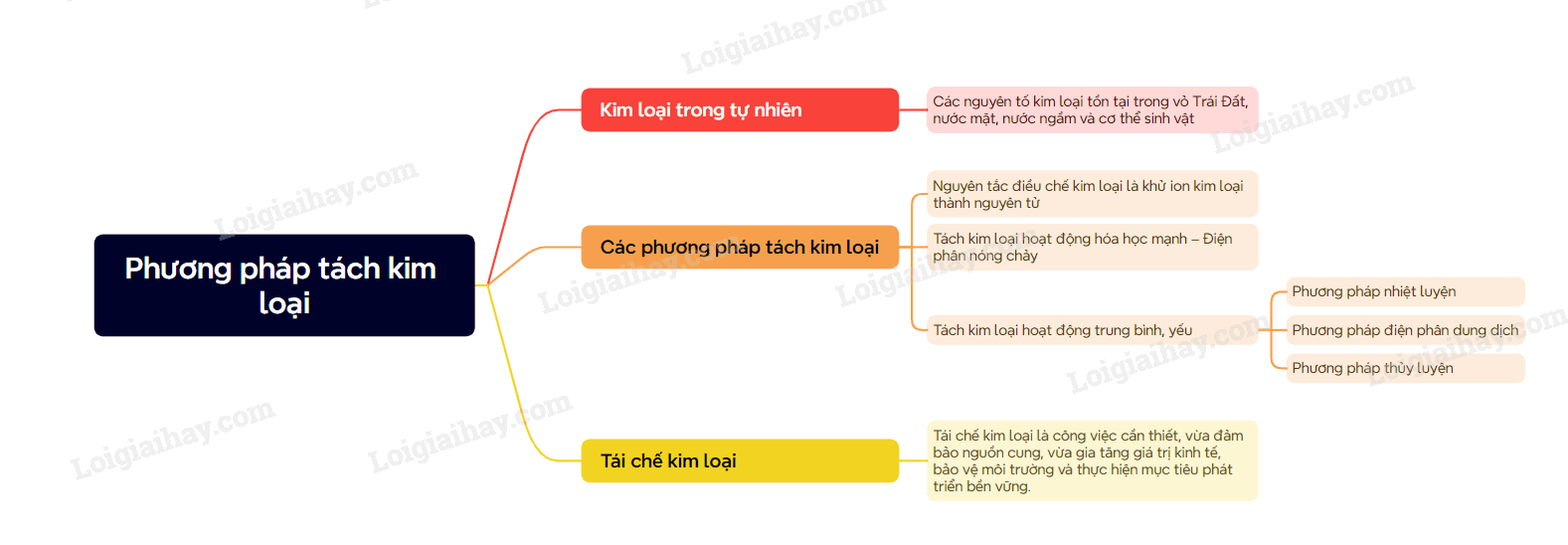
A. Lý thuyết Tách kim loại và tái chế kim loại
I. Trạng thái tự nhiên của kim loại
Các nguyên tố kim loại tồn tại trong vỏ Trái Đất, nước mặt, nước ngầm và cơ thể sinh vật
+ Trong vỏ Trái Đất, đa số các nguyên tố kim loại tồn tại ở dạng hợp chất oxide và muối không tan, một số kim loại quý tồn tại ở dạng đơn chất và hợp kim
+ Trong nước mặt và nước ngầm, các nguyên tố kim loại tồn tại ở dạng cation như Na+, Mg2+, Ca2+
+ Trong cơ thể sinh vật, nguyên tố calcium có trong xương và răng; các nguyên tố như potassium, sắt, đồng,… có trong máu
II. Phương pháp tách kim loại
1. Phương pháp tách các kim loại hoạt động hóa học trung bình và yếu
- Phương pháp nhiệt luyện: Thường được dùng để tách các kim loại hoạt động hóa học trung bình và yếu như Z, Fe, Sn, Pb, Cu,… ra khỏi các oxide bằng các chất khử phù hợp và phổ biến như C, CO,… ở nhiệt độ cao
- Phương pháp thủy luyện: thường được dùng để tách những kim loại hoạt động hóa học yếu như Cu, Ag, Au,… ra khỏi dung dịch muối của chúng bằng các kim loại có tính khử mạnh như Fe, Zn,….
2. Phương pháp tách kim loại hoạt động hóa học mạnh
Phương pháp điện phân dùng để tách các kim loại hoạt động hóa học mạnh
III. Tái chế kim loại
1. Nhu cầu tái chế kim loại
Nhu cầu sử dụng kim loại của con người ngày càng lớn. Tái chế để đáp ứng nhu cầu sử dụng và góp phần bảo vệ tài nguyên và môi trường.
2. Thực tiễn tái chế kim loại

Sơ đồ tư duy Tách kim loại và tái chế kim loại
B. Trắc nghiệm Tách kim loại và tái chế kim loại
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi chỉ chọn một phương án trả lời.
Câu 1: Phương pháp nào sau đây có thể tách được sodium kim loại?
A. Nung nóng mạnh quặng sodium trong không khí.
B. Nung nóng quặng sodium với carbon.
C. Điện phân nước muối.
D. Điện phân muối sodium chloride nóng chảy.
Đáp án đúng là: D
Điện phân muối sodium chloride nóng chảy có thể tách được sodium kim loại.
Câu 2: Cho ba kim loại được tách từ quặng của chúng theo các cách tương ứng sau.
|
Kim loại |
Phương pháp tách thông dụng |
|
X |
Điện phân nóng chảy |
|
Y |
Nhiệt phân, nung nóng trực tiếp |
|
Z |
Nung nóng với carbon |
Khả năng hoạt động hoá học của các kim loại giảm dần theo thứ tự nào sau đây?
A. X, Z, Y.
B. Y, Z, X.
C. X, Y, Z.
D. Z, Y, X.
Đáp án đúng là: A
X cần dùng phương pháp điện phân nóng chảy nên X là kim loại mạnh như Na, K, Ba, Ca, Mg, Al.
Y nhiệt phân, nung nóng trực tiếp nên Y là kim loại rất yếu như Ag, Hg.
Z nung nóng với carbon nên Z là kim loại trung bình như Fe, Cu.
Vậy, khả năng hoạt động hóa học giảm dần theo thứ tự: X, Z, Y.
Câu 3: Cho các oxide kim loại sau: (1) Silver oxide; (2) Calcium oxide và (3) Mercury(II) oxide. Nung nóng oxide kim loại nào ở trên thu được kim loại?
A. (1).
B. (2).
C. (1); (3).
D. (2); (3).
Đáp án đúng là: C
(1) 2Ag2O 4Ag + O2
(3) 2HgO 2Hg + O2
Câu 4: Để khử hoàn toàn một lượng oxide kim loại thành kim loại cần vừa đủ V lít khí H2. Hoà tan lượng kim loại tạo thành bằng H2SO4 loãng, dư thu được V lít H2 (các khí đo cùng điều kiện). Oxide kim loại đó là
A. MgO.
B. Fe2O3.
C. FeO.
D. CuO.
Đáp án đúng là: C
Nhận thấy kim loại Cu không phản ứng với H2SO4 loãng ⇒ loại D.
MgO không bị khử bởi H2 ⇒ loại A.
Oxide kim loại phản ứng với H2 và kim loại tương ứng phản ứng với H2SO4 loãng sinh ra lượng H2 tương ứng (bằng nhau) thì kim loại phản ứng với H2SO4 phải có hóa trị bằng hóa trị của kim loại trong oxide.
Vậy oxide là FeO.
Câu 5: Cho khí CO (dư) đi qua ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4 và CuO, thu được chất rắn Y. Cho Y vào dung dịch NaOH dư, khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm
A. MgO, Fe, Cu.
B. Mg, Fe, Cu.
C. MgO, Fe3O4, Cu.
D. Mg, Al, Fe, Cu
Đáp án đúng là: A
Phương trình hóa học:
Fe3O4 + 4CO 3Fe + 4CO2
CuO + CO Cu + CO2
⇒ Chất rắn Y: Al2O3, MgO, Fe và Cu cho tác dụng với NaOH dư.
Al2O3 + 2NaOH → 2NaAlO2 + H2O
⇒ Chất rắn Z: MgO, Fe và Cu.
Câu 6: Kim loại nào sau đây có thể được điều chế từ hợp chất của nó bằng cách chỉ dùng nhiệt (đun nóng)?
A. Bạc.
B. Nhôm.
C. Sắt.
D. Kẽm.
Đáp án đúng là: A
Ví dụ: AgNO3 Ag + NO2 + O2
Câu 7: Phương pháp thích hợp để điều chế Mg từ MgCl2 là
A. dùng kali khử ion Mg2+ trong dung dịch.
B. điện phân MgCl2 nóng chảy.
C. điện phân dung dịch MgCl2.
D. nhiệt phân MgCl2.
Đáp án đúng là: B
Phương pháp thích hợp để điều chế Mg từ MgCl2 là điện phân MgCl2 nóng chảy.
Câu 8: Có thể thu được kim loại nào trong số các kim loại sau: Cu, Na, Ca, Al bằng cả ba phương pháp điều chế kim loại phổ biến?
A. Na.
B. Ca.
C. Cu.
D. Al.
Đáp án đúng là: C
Cu có thể điều chế bằng phương pháp thủy luyện, nhiệt luyện và điện phân dung dịch.
Phương trình hóa học minh họa:
Fe + CuSO4 → FeSO4 + Cu
CuO + H2 Cu + H2O
CuCl2 Cu + Cl2
Câu 9: Phản ứng nào sau đây không điều chế được kim loại Cu?
A. Cho Fe tác dụng với dung dịch CuSO4.
B. Cho Na tác dụng với dung dịch CuSO4.
C. Điện phân dung dịch CuSO4 (điện cực trơ).
D. Cho H2 tác dụng với CuO, đun nóng.
Đáp án đúng là: B
Cho Na tác dụng với dung dịch CuSO4 không điều chế được kim loại Cu do:
2Na + 2H2O → 2NaOH + H2
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Hay viết gộp:
2Na + 2H2O + CuSO4 → Cu(OH)2 + Na2SO4 + H2
Câu 10: Trong công nghiệp, nhôm được tách ra từ quặng bauxite bằng cách nào sau đây?
A. Nung nóng quặng bauxite.
B. Nung nóng quặng bauxite với carbon.
C. Nung nóng quặng bauxite với hydrogen.
D. Điện phân nóng chảy quặng bauxite.
Đáp án đúng là: D
Trong công nghiệp, nhôm được tách ra từ quặng bauxite bằng cách điện phân nóng chảy quặng bauxite (thành phần chính là Al2O3).
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S).
Câu 11: Cho các phát biểu sau về tách và tinh chế kim loại.
a) Các kim loại Fe, Al, Cu đều có thể điều chế bằng phương pháp dùng CO khử oxide kim loại tương ứng.
b) Trong công nghiệp, kim loại Al chỉ có thể điều chế được bằng phương pháp điện phân.
c) Để tách Ag khỏi các tạp chất Fe, Cu ta có thể cho hỗn hợp vào dung dịch AgNO3 dư.
d) Trong công nghiệp, kim loại Na được điều chế bằng cách điện phân dung dịch NaCl.
a) Sai. Al điều chế bằng phương pháp điện phân nóng chảy.
b) Đúng.
c) Đúng. Fe và Cu phản ứng với AgNO3 dư tạo thành muối tan. Lọc thu kết tủa ta được bạc nguyên chất.
d) Sai. Na được điều chế bằng cách điện phân nóng chảy NaCl.
Câu 12. Xét phương trình hóa học sau: X(s) + CuSO4(aq) → XSO4(aq) + Cu(s)
a) Đây là phương pháp thủy luyện để điều chế kim loại Cu.
b) X là kim loại hoạt động hóa học mạnh hơn Cu.
c) X có thể là kim loại Ca.
d) Phương pháp điều chế trên có thể áp dụng điều chế kim loại Al, Mg trong công nghiệp.
a) Đúng.
b) Đúng.
c) Sai vì Ca sẽ phản ứng với H2O trước sinh ra Ca(OH)2 sau đó Ca(OH)2 mới phản ứng với CuSO4 tạo ra Cu(OH)2 nên sẽ không sinh như phản ứng trên.
d) Sai vì phương pháp thủy luyện thường dùng để tách những kim loại hoạt động hóa học yếu như Cu, Ag, Cu,...
Phần III. Câu trắc nghiệm yêu cầu trả lời ngắn
Câu 13: Dẫn khí CO dư qua ống sử dụng 16 g Fe2O3 nung nóng, sau khi phản ứng xảy ra hoàn toàn thu được m gam kim loại. Giá trị của m là bao nhiêu?
Đáp án đúng là: 11,2 gam
Giải thích:
Bảo toàn nguyên tố:
Câu 14: Cho 14 g bột Fe vào 400 mL dung dịch X gồm AgNO3 0,5 M và Cu(NO3)2 x M. Khuấy nhẹ cho tới khi phản ứng kết thúc thu được dung dịch Y và 30,4 g chất rắn Z. Giá trị của x là
Đáp án đúng là: 0,125
Giải thích:
⇒ Z chứa Ag và Cu (có thể có Fe dư)
Xét dung dịch =>mZ = 108. 0,2 + 64. 0,15 = 31,2 g > 30,4 g(loại)
Vậy dung dịch
Câu 15. Cho 4,958 lít khí CO (ở đkc) từ từ đi qua ống sứ nung nóng đựng 8 g một oxide sắt đến khi phản ứng xảy ra hoàn toàn. Khi thu được sau phản ứng có tỉ khối so với H2 bằng 20. Phần trăm thể tích CO2 trong hỗn hợp khí sau phản ứng là ?
Đáp án đúng là: 75%
Giải thích:
Xem thêm các bài tóm tắt lý thuyết Hóa học lớp 12 Cánh diều hay, chi tiết khác: