Với tóm tắt lý thuyết Hóa học lớp 12 Bài 16: Hợp kim – Sự ăn mòn kim loại sách Cánh diều hay, chi tiết cùng với 10 bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa học 12 Bài 16: Hợp kim – Sự ăn mòn kim loại
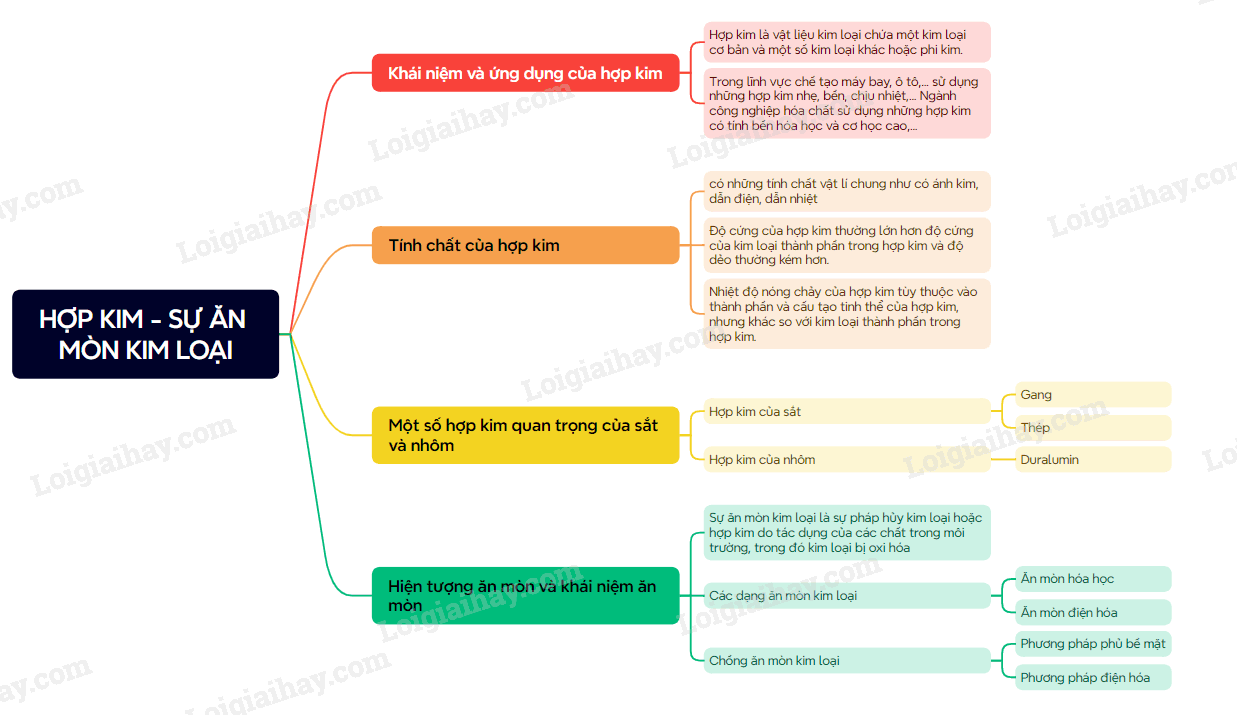
A. Lý thuyết Hợp kim – Sự ăn mòn kim loại
I. Hợp kim
1. Khái niệm hợp kim và việc sử dụng phổ biến của hợp kim
- Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim. Ví dụ: thép là hợp kim, trong đó kim loại cơ bản là sắt, phu kim là carbon và một số kim loại như chromium, nickel,…
- Hợp kim thường khó bị oxi hóa và có một số tính chất đáp ứng được nhiều mục đích sử dụng khác nhau. Vì vậy trong thực tế, hợp kim được sử dụng phổ biến hơn kim loại.
2. Tính chất của hợp kim
- Tính chất hóa học của hợp kim thường tương tự tính chất hóa học của các đơn chất thành phần tham gia tạo hợp kim.
- Tính chất vật lí và tính chất cơ học của hợp kim thường khác nhiều so với tính chất của các đơn chất thành phần tham gia tạo hợp kim.
3. Một số hợp kim của sắt và nhôm
a) Hợp kim của sắt
hầu hết các hợp kim của sắt là thép. Các loại thép có thành phần khác nhau nên tính chất và ứng dụng khác nhau.
Ví dụ:
- Fe và C tạo thép thường, có độ cứng và độ dẻo phù hợp để làm vật liệu trong ngành xây dựng, giao thông và cơ khí.
- Fe, C, Cr và Ni tạo thép không giả, được dùng làm vật liệu chế tạo dao, kéo, dụng cụ phẫu thuật,…
- Gang là hợp kim của sắt và carbon, trong đó có hàm lượng C lớn hơn so với thép. Gang có độ cứng cao nhưng giòn nên khó gia công hơn thép.
b) Hợp kim của nhôm
- Đặc điểm nổi bật nhất của hợp kim nhôm là nhẹ.
- Duralumin (hay dural) là loại hợp kim quan trọng nhất của nhôm, có thành phần gồm nhôm, đồng, magnesium, manganese,…được sử dụng nhiều trong lĩnh vực hàng không vũ trụ để chế tạo cánh máy bay; lĩnh vực quốc phòng để chế tạo áo giáp khiên bảo vệ; lĩnh vực chế tạo ô tô,…
II. Ăn mòn kim loại
1. Hiện tượng ăn mòn và khái niệm ăn mòn
Sự ăn mòn kim loại là sự pháp hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường, trong đó kim loại bị oxi hóa: M Mn+ + ne
2. Các dạng ăn mòn kim loại
a) Ăn mòn hóa học
Ăn mòn hóa học là quá trình oxi hóa – khử, trong đó các electron của kim loại chuyển trực tiếp đến các chất trong môi trường.
b) Ăn mòn điện hóa
Ăn mòn điện hóa là quá trình ăn mòn kim loại do sự tạo thành pin điện hóa.
Điều kiện xảy ra sự ăn mòn điện hóa
1. Có hai kim loại khác nhau hoặc kim loại với phi kim,…
2. Tiếp xúc trực tiếp với nhau hoặc gián tiếp qua dây dẫn điện
3. Cùng tiếp xúc với một dung dịch chất điện li
Thiếu một trong ba điều kiện trên sẽ không xảy ra sự ăn mòn điện hóa
3. Chống ăn mòn kim loại
a) Phương pháp phủ bề mặt
Phương pháp bảo vệ bề mặt là phủ lên bề mặt của kim loại một lớp sơn, dầu, mỡ, chất dẻo hoặc tráng, mạ bằng một kim loại khác.
b) Phương pháp điện hóa
Trong phương pháp điện hóa, để bảo vệ kim loại, người ta nối kim loại cần bảo vệ với một kim loại hoạt động hóa học mạnh hơn.
Sơ đồ tư duy Hợp kim - Sự ăn mòn kim loại
B. Trắc nghiệm Hợp kim – Sự ăn mòn kim loại
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi chỉ chọn một phương án trả lời.
Câu 1: Hiện tượng nào sau đây không phải là hiện tượng ăn mòn kim loại?
A. Ống thép bị gỉ sắt màu nâu đỏ.
B. Vòng bạc bị xỉn màu.
C. Công trình bằng đá bị ăn mòn bởi mưa acid.
D. Chuông đồng bị gỉ đồng màu xanh.
Đáp án đúng là: C
Công trình bằng đá bị ăn mòn bởi mưa acid không phải là hiện tượng ăn mòn kim loại.
Câu 2: Trong hiện tượng ăn mòn kim loại xảy ra quá trình nào sau đây?
A. Quá trình oxi hoá kim loại.
B. Quá trình khử kim loại.
C. Quá trình điện phân.
D. Sự mài mòn kim loại.
Đáp án đúng là: A
Trong hiện tượng ăn mòn kim loại xảy ra quá trình oxi hoá kim loại.
Câu 3: Trường hợp nào sau đây kim loại bị ăn mòn điện hoá học?
A. Đốt dây sắt trong khí oxygen khô.
B. Thép carbon để trong không khí ẩm.
C. Kim loại kẽm trong dung dịch HCl.
D. Kim loại sắt trong dung dịch HNO3 loãng.
Đáp án đúng là: B
Trường hợp kim loại bị ăn mòn điện hoá học là thép carbon để trong không khí ẩm.
Câu 4: Đinh sắt bị ăn mòn khi gắn với kim loại nào sau đây?
A. Magnesium.
B. Nhôm.
C. Kẽm.
D. Đồng.
Đáp án đúng là: D
Khi đinh sắt gắn với đồng thì sắt mạnh hơn đồng nên sẽ bị ăn mòn trước.
Câu 5: Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại nào sau đây?
A. Sn.
B. Pb.
C. Zn.
D. Cu.
Đáp án đúng là: C
Để hạn chế sự ăn mòn của vỏ tàu biển (làm bằng thép), người ta gắn vào vỏ tàu biển (phần ngâm dưới nước) những tấm kim loại của Zn, vì Zn có tính khử mạnh hơn Fe đóng vai trò là cực âm (kim loại bị ăn mòn thay sắt), nhưng tốc độ ăn mòn của kẽm tương đối nhỏ và giá thành không quá cao → vỏ tàu được bảo vệ trong thời gian dài.
Câu 6: Đồng đỏ hay đồng thiếc là một hợp kim của
A. đồng và nickel.
B. đồng và sắt.
C. đồng và thiếc.
D. đồng và aluminium.
Đáp án đúng là: C
Đồng đỏ hay đồng thiếc là một hợp kim của đồng và thiếc.
Câu 7: Chất hay hỗn hợp chất nào sau đây không phải là hợp kim?
A. Thép.
B. Đồng.
C. Đồng thau.
D. Đồng thiếc.
Đáp án đúng là: B
Đồng là kim loại, không phải là hợp kim.
Câu 8: Thêm chromium vào thép thì tính chất nào sau đây được tăng cường?
A. Chống ăn mòn.
B. Tính dẫn điện.
C. Tính chất từ.
D. Tính dễ kéo sợi.
Đáp án đúng là: A
Thêm chromium vào thép thì tính chống ăn mòn được tăng cường.
Câu 9: Hợp kim nào sau đây được sử dụng để làm cấu trúc thân vỏ máy bay?
A. Duralumin.
B. Đồng thau (Brass).
C. Đồng thiếc (Bronze).
D. Manganin.
Đáp án đúng là: A
Hợp kim duralumin bền, nhẹ nên được sử dụng để làm cấu trúc thân vỏ máy bay.
Câu 10: Khi chế tạo thép từ gang, có thể làm giảm tỉ lệ phần trăm carbon trong gang bằng cách nào sau đây?
A. Sử dụng oxygen để đốt cháy carbon trong gang nóng chảy.
B. Lọc carbon ra khỏi gang.
C. Hoà tan carbon trong dung dịch sulfuric acid.
D. Cạo carbon ra khỏi bề mặt kim loại.
Đáp án đúng là: A
Khi chế tạo thép từ gang, có thể làm giảm tỉ lệ phần trăm carbon trong gang bằng cách sử dụng oxygen để đốt cháy carbon trong gang nóng chảy.
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Câu 11: Cho các nhận xét sau về hợp kim:
a) Trong hợp kim, kim loại chính có hàm lượng lớn nhất được gọi là kim loại cơ bản.
b) Trong hợp kim, tên của kim loại cơ bản được sử dụng làm tên gọi của hợp kim.
c) Trong hợp kim, kim loại cơ bản có hàm lượng lớn nhất được gọi là chất tan.
d) Trong hợp kim, kim loại cơ bản có hàm lượng trên 90%.
a) Đúng, trong hợp kim, kim loại chính có hàm lượng lớn nhất được gọi là kim loại cơ bản.
b) Sai, hợp kim thường được đặt tên riêng.
c) Sai, chất tan là chất có thể hòa tan được trong chất khác (dung môi).
d) Sai, kim loại cơ bản là kim loại chiếm hàm lượng cao nhất trong hợp kim.
Câu 12: Sự ăn mòn điện hoá xảy ra khi
a) cho miếng hợp kim Ag - Cu trong dung dịch HCl loãng.
b) đặt hợp kim Zn - Cu trong không khí ẩm.
c) đốt hợp kim Zn - Fe trong bình chứa khí O2 dư.
d) ngâm kim loại Cu tinh khiết trong dung dịch muối ăn.
a) sai. Không xảy ra ăn mòn điện hóa.
b) đúng.
c) sai. Xảy ra ăn mòn hoá học.
d) sai. Không xảy ra ăn mòn điện hóa do không xuất hiện 2 điện cực.
Phần III. Trắc nghiệm yêu cầu trả lời ngắn
Câu 13. Trong hợp kim Al – Mg, cứ có 8 mol Al thì có 2 mol Mg. Tính thành phần phần trăm về khối lượng của Al trong hợp kim. (Làm tròn kết quả đến hàng phần mười).
Đáp số: 81,8.
Giải thích:
Câu 14: Cho các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau: Fe và Pb; Fe và Zn; Fe và Sn; Fe và Ni. Khi nhúng các cặp kim loại trên vào dung dịch acid, số cặp kim loại trong đó Fe bị phá huỷ trước là?
Đáp án đúng là: 3
Giải thích:
Các cặp trong đó Fe bị phá huỷ trước là Fe và Pb; Fe và Sn; Fe và Ni.
Câu 15: Trong ống nghiệm nào sau đây, đinh sắt sẽ bị gỉ sau vài ngày?
Đáp án đúng là: ống nghiệm a.
Xem thêm các bài tóm tắt lý thuyết Hóa học lớp 12 Cánh diều hay, chi tiết khác: