Với tóm tắt lý thuyết Hóa học lớp 12 Bài 20: Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch sách Chân trời sáng tạo hay, chi tiết cùng với 10 bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa học 12 Bài 20: Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
A. Lý thuyết Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
1. Thành phần và dạng hình học của phức chất
- Trong phức chất có nguyên tử trung tâm (còn gọi là nhân trung tâm) và phối tử. Liên kết giữa phối tử và nguyên tử trung tâm là liên kết cho – nhận, trong đó phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm.
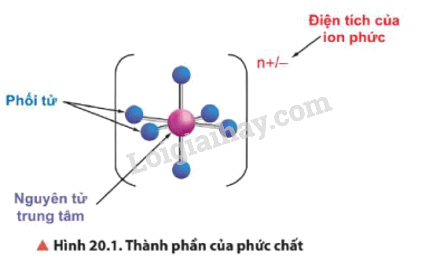
Ví dụ: phức chất [Cr(NH3)6]3+ có nguyên tử trung tâm là Cr3+ và phối tử là NH3
- Dạng hình học của phức chất phổ biến là tứ diện, vuông phẳng và bát diện
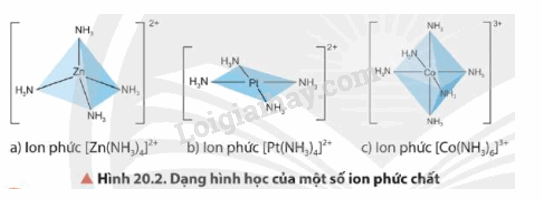
2. Sự hình thành phức chất trong dung dịch
- Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hóa trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau:;
Mn+(aq) + m H2O(l) [M(OH2)m]n+(aq)
Với: n là giá trị điện tích của cation kim loại M
m là số phối tử H2O
[M(OH2)m]n+ là công thức tổng quát của phức chất aqua của Mn+.
- Phản ứng thay thế phối tử trong phức chất
Ở những điều kiện phù hợp, các anion và phân tử như OH-, X- (halide), NH3,…. Có thể thay thế được một, một số hoặc tất cả các phối tử trong phức chất
Ví dụ: [Cr(OH2)6]3+(aq) + 6OH-(aq) [Cr(OH)6]3-(aq) + 6H2O(l)
- Dấu hiệu của phản ứng tạo phức chất trong dung dịch
Các phản ứng tạo phức chất thường có một số dấu hiệu dễ quan sát như sự biến đổi máu sắc, sự hòa tan, sự kết tủa. Trong các dấu hiệu trên, sự biến đổi màu sắc là phổ biến hơn cả
- Phản ứng thay thế phối tử trong phức chất
Ở những điều kiện phù hợp, các anion và phân tử như OH-, X- (halide), NH3,…. Có thể thay thế được một, một số hoặc tất cả các phối tử trong phức chất
Ví dụ: [Cr(OH2)6]3+(aq) + 6OH-(aq) [Cr(OH)6]3-(aq) + 6H2O(l)
3. Một số ứng dụng của phức chất
- Phức chất có nhiều ứng dụng trong lĩnh vực, như y họcc, dược hóa, hóa học,…
- Phức chất có ý nghĩa to lớn trong ngành y học và dược học. Nhiều dẫn xuất có hoạt tính sinh học trên cơ thể người là phức chất của các kim loại như Cu, Zn, Co, Pt, Au,… Đây là cơ sở cho việc sản xuất thuốc chữa bệnh.
Sơ đồ tư duy Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
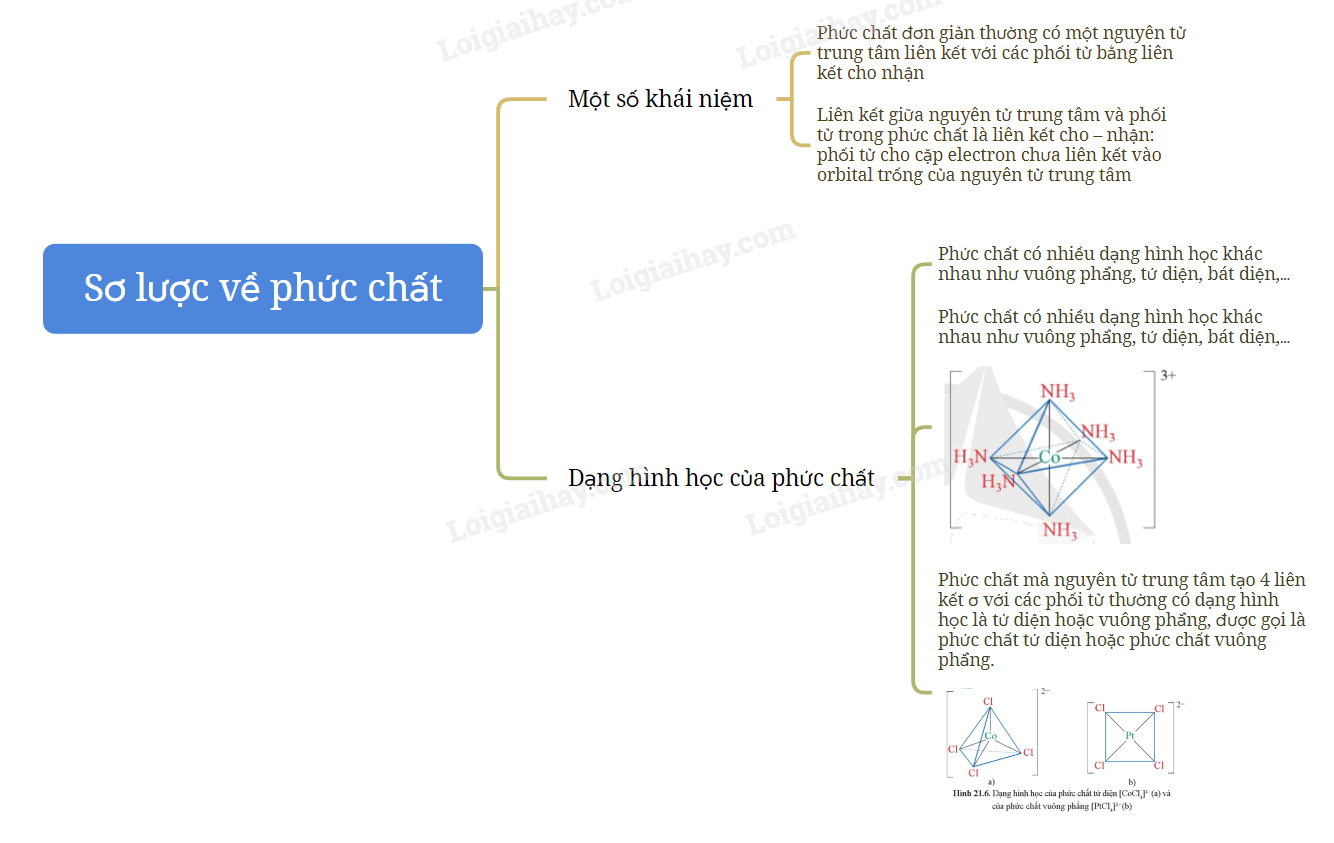
B. Trắc nghiệm Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
Câu 1. Điện tích của nguyên tử trung tâm trong phức chất [Co(NH3)6]3+và [FeF6]3- lần lượt là
A. +3 và +3.
B. +3 và +2.
C. +6 và -6.
D. +3 và -3.
Đáp án đúng là: A
Điện tích của nguyên tử trung tâm trong phức chất [Co(NH3)6]3+và [FeF6]3- lần lượt là +3 và +3.
Câu 2. Nhận xét nào sau đây là không đúng?
A. Nguyên tử trung tâm chỉ có thể là cation kim loại.
B. Thành phần của phức chất có nguyên tử trung tâm và phối tử.
C. Phối tử còn cặp electron chưa liên kết, có khả năng cho nguyên tử trung tâm.
D. Liên kết giữa phối tử và nguyên tử trung tâm là liên kết cho – nhận.
Đáp án đúng là: A
Trong phức chất, nguyên tử trung tâm có thể là cation kim loại hoặc nguyên tử kim loại.
Câu 3. Phức chất có dạng hình học không phải tứ diện là
A. [CoBr4]2-.
B. [PtBr4]2-.
C. [AI(OH)4]-.
D. [FeCl4]-.
Đáp án đúng là: D
Phức chất có dạng hình học không phải tứ diện là[PtBr4]2-.
Câu 4. Nhỏ từng giọt dung dịch sodium hydroxide cho đến dư vào dung dịch aluminium chloride, dấu hiệu chứng tỏ đã tạo ra phức chất chứa phối từ OH- là
A. kết tủa bị hoà tan.
B. dung dịch bị chuyển từ không màu sang có màu.
C. kết tủa keo trắng tạo thành.
D. dung dịch bị mất màu.
Đáp án đúng là: A
AlCl3 + 3NaOH Al(OH)3↓ + 3NaCl.
Al(OH)3 + NaOH Na[Al(OH)4]
Câu 5. Theo thuyết Liên kết hoá trị, để trở thành phối tử trong phức chất thì phân tử hoặc anion cần có
A. các orbital trống.
B. cặp electron hoá trị riêng.
C. ít nhất 4 orbital trống.
D. ít nhất hai cặp electron hoá trị riêng.
Đáp án đúng là: B
Theo thuyết Liên kết hoá trị, để trở thành phối tử trong phức chất thì phân tử hoặc anion cần cócặp electron hoá trị riêng.
Câu 6: Trong phức chất, giữa phối tử và nguyên tử trung tâm có loại liên kết nào sau đây?
A. Ion.
B. Hydrogen.
C. Cho-nhận.
D. Kim loại.
Đáp án đúng là: B
Trong phức chất, giữa phối tử và nguyên tử trung tâm cóliên kết cho nhận.
Câu 7. Phối tử trong phức chất [PtCl4]2- và [Fe(CO)5] là
A. Cl và C.
B. Pt và Fe.
C. Cl– và CO.
D. Cl và CO.
Đáp án đúng là: C
Phối tử trong phức chất [PtCl4]2- và [Fe(CO)5] làCl– và CO.
Câu 8. Số lượng phối tử có trong mỗi phức chất [PtCl4]2- và [Fe(CO)5] là
A. 4 và 5.
B. 5 và 6.
C. 5 và 2.
D. 1 và 2.
Đáp án đúng là: B
Số lượng phối tử có trong mỗi phức chất [PtCl4]2- và [Fe(CO)5] là 4 và 5.
Câu 9. Công thức tổng quát của phức chất (với nguyên tử trung tâm M và phối tử L) có dạng tứ diện và bát diện lần lượt là
A. [ML2] và [ML4].
B. [ML4] và [ML6].
C. [ML6] và [ML2].
D. [ML6] và [ML4].
Đáp án đúng là: B
Công thức tổng quát của phức chất (với nguyên tử trung tâm M và phối tử L) có dạng tứ diện và bát diện lần lượt là[ML4] và [ML6].
Câu 10. Cho phát biểu đúng nhất về dạng hình học có thể có của phức chất có dạng tổng quát [ML4]?
A. Tứ diện.
B. Bát diện.
C. Vuông phẳng.
D. Tứ diện hoặc vuông phẳng.
Đáp án đúng là: D
Phức chất có dạng tổng quát [ML4] tứ diện hoặc vuông phẳng.
Câu 11: Cho hai phức chất A và B có công thức lần lượt sau:
Mỗi phát biểu sau đây đúng hay sai?
|
Phát biểu |
Đúng |
Sai |
|
a. Nguyên tử trung tâm của hai phức chất đều là nguyên tố kim loại chuyển tiếp. |
||
|
b. Trong phức chất A có 4 phối tử. |
||
|
c. Hai phức chất A và B có dạng hình học khác nhau. |
||
|
d. Trong A và trong B đều có hai loại phối tử. |
a – Sai. Mg không là nguyên tố kim loại chuyển tiếp.
b – Sai. Vì A có 6 phối tử.
c – Đúng.
d – Sai. Ở B chỉ có một loại phối tử.
Câu 12: Hãy chọn đúng hoặc sai cho mỗi ý.
|
Phát biểu |
Đúng |
Sai |
|
a. Nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại có orbital trống đã nhận cặp electron chưa liên kết của phối tử. |
||
|
b. Phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm. |
||
|
c. Phức lập phương chỉ biết đối với các ion có kích thước rất lớn so với kích thước phối tử. |
||
|
d. Phức chất luôn mang điện tích dương hoặc âm. |
a – Đúng.
b – Đúng.
c – Đúng.
d – Sai. Vì phức chất có thể mang điện tích hoặc không mang điện tích.
Câu 13. Cấu hình electron của sắt (Fe) là Xác định số electron độc thân trong ion
Đáp án đúng là: 4
Giải thích:
Biểu diễn cấu hình electron theo AO:
Số electron độc thân trong ion là 4.
Câu 14. Phức chất X có công thức hóa học là Có bao nhiêu liên sigma có trong phức chất X?
Đáp án đúng là: 20
Giải thích:
Mỗi phối tử có 3 liên kết sigma. Liên kết giữa Pt với phối tử chứa 1 liên kết sigma.
⇒ Tổng số liên kết sigma là: 4 + 3.4 + 4 = 20.
Câu 15. Nguyên tử trung tâm của phức chất có công thức hóa học là có số oxi hóa là bao nhiêu?
Đáp án đúng là: +3
Giải thích:
Gọi x là số oxi hóa của nguyên tử trung tâm.
⇒ +1 + x + (-1).4 = 0 → x = +3.
Xem thêm các bài tóm tắt lý thuyết Hóa học lớp 12 Chân trời sáng tạo hay, chi tiết khác: