Với tóm tắt lý thuyết Hóa học lớp 12 Bài 12: Thế điện cực và nguồn điện hoá học sách Chân trời sáng tạo hay, chi tiết cùng với 10 bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa học 12 Bài 12: Thế điện cực và nguồn điện hoá học
A. Lý thuyết Thế điện cực và nguồn điện hoá học
1. Cặp oxi hóa – khử của kim loại
- Xét một quá trình có ion kim loại Mn+ đóng vai trò là chất oxi hóa và một quá trình kim loại M đóng vai trò là chất khử như sau:
Mn+ + ne M
M Mn+ + ne
- Trong trường hợp trên, chất oxi hóa (dạng oxi hóa) Mn+ và chất khử (dạng khử). M thuộc cùng một nguyên tố kim loại. Quá trình trên được viết gọn như sau:
Mn+ + ne M
Dạng oxi hóa Dạng khử
- Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại đó.
2. Thế điện cực chuẩn của kim loại và pin galvani
- Pin Galvanin Zn – Cu gồm điện cực kẽm và điện cực đồng. Hai điện cực được nối với nhau bằng cầu muối. Khi pin hoạt động, ở điện cực âm (anode) xảy ra quá trình oxi hóa Zn và ở điện cực dương (cathode) xảy ra quá trình khử ion Cu2+.
- Thế điện cực chuẩn Eo của kim loại có thể xác định bằng cách đo sức điện động của pin tạo bởi điện cực hydrogen chuẩn và điện cực chuẩn của kim loại cần đo.
3. Ý nghĩa của dãy thế điện cực chuẩn kim loại
- Khi biết giá trị thế điện cực chuẩn của các cặp oxi hóa – khử, có thể so sánh được khả năng khử giữa các dạng khử và khả năng oxi hóa giữa các dạng oxi hóa ở điều kiện chuẩn.
- Kim loại trong cặp oxi hóa – khử có thế điện cực chuẩn âm có thể khử được ion hydrogen (H+) trong dung dịch acid ở điều kiện chuẩn
- Sức điện động chuẩn của pin điện hóa:
4. Một số loại pin khác
- Pin nhiên liệu: hoạt động dựa trên phản ứng oxi hóa – khử giữa nhiên liệu và chất oxi hóa. Pin nhiên liệu phổ biến hiện nay là pin hydrogen. Ưu điểm của pin nhiên liệu là nhiên liệu được bổ sung liên tục nên thời gian hoạt động của pin không bị hạn chế. Nhược điểm của pin nhiên liệu là công nghiệp chưa được phổ biến và giá thành cao.
- Pin mặt trời bao gồm nhiều tế bào quang điện làm biến đổi năng lượng ánh sáng thành ănng lượng điện. Ưu điểm tạo được nguồn năng lượng xanh, thân thiện với môi trường, chi phí không quá cao, sử dụng lâu dài tuy nhiên, pin mặt trời cần được lắp đặt trên không gian rộng để pin tiếp xúc trực tiếp với ánh sáng mặt trời. Loại pin này khó di chuyển
- Acquy đơn giản là acquy chì, gồm bản cực dương bằng PbO2, bản cực âm bằng Pb, cả hai điện cực được đặt vào dung dịch H2SO4 loãng.
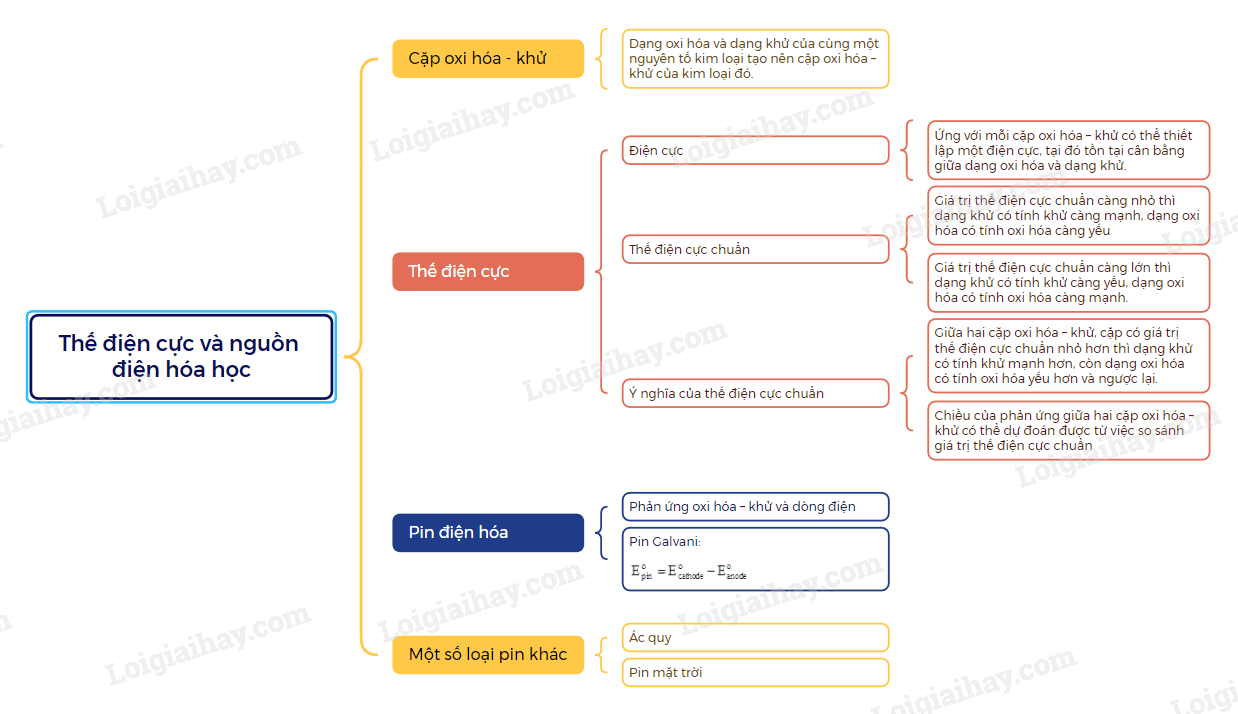
Sơ đồ tư duy Thế điện cực và Nguồn điện hóa học
B. Trắc nghiệm Thế điện cực và nguồn điện hoá học
Câu 1. Trong dãy điện hoá của kim loại, khi đi từ trái sang phải, tính oxi hoá của cảc ion kim loại biến đổi như thế nào?
A. Không đổi.
B. Tuần hoàn.
C. Giảm dần.
D. Tăng dần.
Đáp án đúng là: D
Trong dãy điện hoá của kim loại, khi đi từ trái sang phải, tính oxi hoá của cảc ion kim loại tăng dần.
Câu 2. Cho thứ tự sắp xếp các cặp oxi hoá - khử trong dãy điện hoá: Mg2+/Mg; H2O/H2, OH-; 2H+/H2; Ag+/Ag. Thí nghiệm nào sau đây không xảy ra phản ứng ở điều kiện chuẩn?
A. Cho sợi phoi bào Mg vào nước.
B. Cho lá Mg vào dung dịch HCl.
C. Cho lá Ag vào dung dịch H2SO4.
D. Cho sợi Mg vào dung dịch AgNO3.
Đáp án đúng là: C
Trong dãy điện hóa của kim loại, Ag+/Ag đứng sau 2H+/H2.
Câu 3. Dự đoán hiện tượng nào sau đây sẽ xảy ra khi dùng một chiếc thìa bằng đồng khuấy vào cốc chứa dung dịch aluminium nitrate.
A. Chiếc thìa bị phủ một lớp nhôm.
B. Một hỗn hợp đồng và nhôm được tạo thành.
C. Dung dịch trở nên xanh.
D. Không biến đổi hóa học nào xảy ra.
Đáp án đúng là: D
Cu có tính khử yếu hơn Al nên không xảy ra phản ứng.
Câu 4. Cho các thông tin sau:
X(s) + YSO4(aq) không có phản ứng
Z(s) + YSO4 (aq) Y(s) + ZSO4 (aq)
Trong đó, X, Y, Z là các kim loại. Dãy nào sau đây sắp xếp đúng các kim loại theo mức độ hoạt động của chúng?
A. Z > Y > X.
B. X > Y > Z.
C. Y > X > Z.
D. Y > Z > X.
Đáp án đúng là: A
Từ quá trình (1) có tính khử của Y mạnh hơn X. Từ quá trình (2) có tính khử của Z mạnh hơn Y.
Câu 5. Một học sinh thực hiện ba thí nghiệm ở điều kiện chuẩn và quan sát được các hiện tượng sau:
(1) Đồng kim loại không phản ứng được với dung dịch Pb(NO3)2 1M.
(2) Chì kim loại tan trong dung dịch AgNO3 1M và xuất hiện tinh thể Ag.
(3) Bạc kim loại không phản ứng với dung dịch Cu(NO3)2 1M.
Trật tự nào sau đây thể hiện đúng mức độ khử của 3 kim loại ?
A. Cu>Pb>Ag.
B. Pb>Cu>Ag.
C. Cu>Ag>Pb.
D. Pb>Ag>Cu.
Đáp án đúng là: B
Từ (1): Tính khử của Pb mạnh hơn Cu.
Từ (2): Tính khử của Pb mạnh hơn Ag.
Từ (3): Tính khử của Cu mạnh hơn Ag.
Vậy Pb > Cu > Ag.
Câu 6: Mối liên hệ giữa dạng oxi hoá và dạng khử của kim loại M được biểu diễn ở dạng quá trình khử là
A. M→Mn++ne.
B. Mn++ne→M.
C. Mn+ →M+ne.
D. M+ne→Mn+.
Đáp án đúng là: B
Quá trình khử là quá trình nhận electron.
Mối liên hệ giữa dạng oxi hoá và dạng khử của kim loại M được biểu diễn ở dạng quá trình khử là Mn++ne→M.
Câu 7. Kí hiệu cặp oxi hoá-khử ứng với quá trình khử:Fe3++1e→Fe2+ là
A. Fe3+/Fe2+.
B. Fe2+/Fe.
C. Fe3+/Fe.
D. Fe2+/Fe3+.
Đáp án đúng là: A
Cặp Fe3+/Fe2+ ứng với quá trình khử Fe3++1e→Fe2+.
Câu 8. Trong số các ion: Ag+,Al3+,Fe2+,Cu2+,ion nào có tính oxi hoá mạnh nhất ở điều kiện chuẩn?
A. Ag+.
B. Al3+.
C. Fe2+.
D. Cu2+.
Đáp án đúng là: A
Cặp oxi hóa khử có thế điện cực chuẩn càng lớn tính oxi hóa của dạng oxi hóa càng mạnh.
Vậy trong số các ion đã cho ion Ag+ có tính oxi hóa mạnh nhất.
Câu 9. Cho các cặp oxi hoá - khử của các kim loại và thế điện cực chuẩn tương ứng:
|
Cặp oxi hoá-khử |
Li+/Li |
Mg2+/Mg |
Zn2+/Zn |
Ag+/Ag |
|
Thế điện cực chuẩn,V |
-3,040 |
-2,356 |
-0,762 |
+0,799 |
Trong số các kim loại trên,kim loại có tính khử mạnh nhất là
A. Li.
B. Mg.
C. Zn.
D. Ag.
Đáp án đúng là: A
Cặp oxi hóa khử có thế điện cực chuẩn càng nhỏ thì dạng khử có tính khử càng mạnh.
Vậy trong số các kim loại đã cho, kim loại Li có tính khử mạnh nhất.
Câu 10. Cặp oxi hoá - khử nào sau đây có giá trị thế điện cực chuẩn nhỏ hơn 0?
A. Ag+/Ag.
B. Na+/Na.
C. Hg2+/Hg.
D. Cu2+/Cu.
Đáp án đúng là: B
Câu 11: Pin Galvani Zn-Cu gồm một điện cực kẽm và một điện cực đồng được nối với nhau bởi cầu muối (thường là dung dịch KCl bão hòa) như hình dưới:
|
Phát biểu |
Đúng |
Sai |
|
a. Zn có tính khử mạnh hơn Cu. |
||
|
b. Zn có tính khử yếu hơn Cu. |
||
|
c. Ion Zn2+ có tính oxi hóa mạnh hơn ion Cu2+. |
||
|
d. Ion Zn2+ có tính oxi hóa yếu hơn ion Cu2+. |
a – Đúng.
b – Sai.Vì Zn có tính khử mạnh hơn Cu.
c – Sai. Ion Zn2+ có tính oxi hóa yếu hơn ion Cu2+.
d – Đúng.
Câu 12: Cho các cặp oxi hóa – khử: Al3+/Al; Cr3+/Cr; Co2+/Co; Sn4+/Sn và Cl2 (g)/2Cl- với các thế khử chuẩn lần lượt là -1,676 V; -0,740 V; -0,280 V; 0,150 V và 1,360 V.
|
Phát biểu |
Đúng |
Sai |
|
a. Al có tính khử mạnh nhất. |
||
|
b. Co có khả năng khử Cr3+ (aq) thành Cr (s) ở điều kiện chuẩn. |
||
|
c. Al có khả năng khử Sn4+ (aq) thành Sn2+ (aq) nhưng không khử được Cr3+ (aq) thành Cr (s) ở điều kiện chuẩn. |
||
|
d. Chất có tính oxi hóa mạnh nhất là Cl-. |
a – Đúng.
b – Sai. Vì thế khử chuẩn của Co2+/Co nhỏ hơn Cr3+/Cr.
c – Sai. Vì Al có thể khử 2 trường hợp do có thế khử chuẩn lớn nhất.
d – Đúng.
Câu 13: Cho các cặp oxi hoá-khử của kimloại và thế điện cực chuẩn tương ứng:
|
Cặp oxi hoá - khử |
Na+/Na |
Ca2+/Ca |
Ni2+/Ni |
Au3+/Au |
|
Thế điện cực chuẩn (V) |
-2,713 |
-2,84 |
-0,257 |
+1,52 |
Trong các kim loại trên, có bao nhiêu kim loại tác dụng được với dung dịch HCl ở điều kiện chuẩn, giải phóng khí H2?
Đáp án đúng là: 3
Giải thích:
Kim loại tác dụng được với dung dịch HCl tạo khí H2 là kim loại đứng trước cặp 2H+/H2 trong dãy điện hóa học của kim loại tức có E0 < 0. Vậy trong 4 cặp oxi hóa khử trên có Na, Ca, Ni tác dụng được với dung dịch HCl.
Câu 14:Sức điện động chuẩn của pin điện hoá H2–Cu (gồm hai điện cực ứng với hai cặp oxihoá – khử là 2H+/H2 và Cu2+/Cu) đo được bằng vôn kế có điện trở vô cùng lớn là 0,340V.Từ đó,xác định thế điện cực chuẩn của cặp Cu2+/ Cu?
Đáp án đúng là: +0,340 V
Giải thích:
Epin = E°cathode - E°anode
⇔0,340= E°Cu2+/Cu - 0,000 ⇒E°Cu2+/Cu= +0,340 V
Câu 15: Thiết lập pin điện hóa ở điều kiện chuẩn gồm hai điện cực tạo bởi các cặp oxi hóa – khử Ni2+/Ni ()và Cd2+/Cd (). Sức điện động chuẩn của pin điện hoá trên?
Đáp án đúng là: +0,146 V
Giải thích:
Epin = E°cathode - E°anode
= E°Ni2+/Ni- E°Cd2+/Cd = -0,257V – (-0,403V) = +0,146 V.
Xem thêm các bài tóm tắt lý thuyết Hóa học lớp 12 Chân trời sáng tạo hay, chi tiết khác: