Lời giải bài tập Hóa học lớp 12 Bài 12: Thế điện cực và nguồn điện hoá học sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 12: Thế điện cực và nguồn điện hoá học
Cấu tạo và nguyên tắc hoạt động của pin như thế nào?
Lời giải:
- Cấu tạo: Pin Galvani gồm 2 điện cực có thế điện cực khác nhau, thường được ghép với nhau qua cầu muối.
- Nguyên tắc hoạt động: Pin Galvani chuyển năng lượng của phản ứng hoá học thành năng lượng điện.
Câu hỏi 1 trang 64 Hóa học 12: Xác định dạng oxi hoá và dạng khử trong các quá trình (2) và (3).
Lời giải:
Quá trình (2):
Dạng oxi hóa Dạng khử
Quá trình (3):
Dạng oxi hóa Dạng khử
Câu hỏi 2 trang 64 Hóa học 12: Viết các cặp oxi hóa - khử trong quá trình (2) và (3).
Lời giải:
Cặp oxi hóa khử ở quá trình (2): Cu2+/Cu.
Cặp oxi hóa khử ở quá trình (3): Ag+/Ag.
Luyện tập trang 64 Hóa học 12: Viết các cặp oxi hoá - khử của kim loại Na, Mg và Al.
Lời giải:
|
Kim loại |
Cặp oxi hóa – khử |
|
Na |
Na+/Na |
|
Mg |
Mg2+/Mg |
|
Al |
Al3+/Al |
Lời giải:
- Cấu tạo của pin Galvani: hai điện cực (Zn và Cu), cầu muối.
- Cực dương của pin là điện cực Cu, cực âm của pin là điện cực Zn.
- Electron di chuyển từ cực âm (thanh Zn) qua dây dẫn đến cực dương (thanh Cu).
Câu hỏi 4 trang 65 Hóa học 12: Điện cực nào bị tan dần trong pin Galvani Zn-Cu?
Lời giải:
Trong pin Galvani Zn-Cu, xảy ra các quá trình sau:
+ Anode (-):
+ Cathode (+):
=> Điện cực Zn bị tan dần.
Lời giải:
Ta có:
- Tính oxi hóa: Li+ < Fe2+ < Ag+.
- Tính khử: Ag < Fe < Li.
Lời giải:
- Ta có: ;
=> Al phản ứng được với dung dịch HCl; Ag không phản ứng được với dung dịch HCl.
- Phương trình hóa học:
Lời giải:
- Trong pin điện hóa Zn – Pb:
+ Cathode: Pb.
+ Anode: Zn.
- Sức điện động chuẩn của pin:
Câu hỏi 8 trang 68 Hóa học 12: Hãy nêu một số ứng dụng của pin mặt trời trong đời sống.
Lời giải:
Ứng dụng của pin mặt trời:
- Trạm sạc năng lượng mặt trời: cung cấp nguồn năng lượng vô tận để sạc các thiết bị di động như điện thoại, máy tính bảng, laptop…
- Thùng rác năng lượng mặt trời: thùng rác thông minh có chức năng lọc nước thải để nuôi cây xanh và có thể sạc pin điện thoại bằng năng lượng mặt trời ở Đà Nẵng.
- Đèn đường năng lượng mặt trời.
- Xe ô tô năng lượng mặt trời,…
Câu hỏi 9 trang 68 Hóa học 12: Hãy nêu một số thiết bị sử dụng acquy mà em biết.
Lời giải:
Các thiết bị sử dụng acquy: xe máy; ô tô; máy phát điện; hệ thống báo cháy, chống trộm;…
Lời giải:
|
Các loại pin |
Ưu điểm |
Nhược điểm |
|
Pin nhiên liệu |
Thời gian hoạt động của pin không bị hạn chế. |
- Chưa được phổ biến - Giá thành cao. |
|
Pin mặt trời |
- Thân thiện với môi trường. - Chi phí không quá cao. - Thời gian sử dụng dài. |
- Phải lắp đặt ở không gian rộng rãi. - Khó di chuyển. |
|
Acquy |
- Dung lượng cao. - Tuổi thọ cao. - Khả năng chịu tải cao. - Dễ dàng tích hợp với nhiều thiết bị khác nhau. |
- Thời gian sạc lâu. - Nặng. - Giá thành cao,… |
Lời giải:
Thí nghiệm. Lắp ráp pin khoai tây và đo sức điện động của pin.
- Dụng cụ: thanh kim loại đồng và kẽm; vôn kế; 2 dây dẫn.
- Nguyên liệu: 1 quả khoai tây tươi.
- Tiến hành thí nghiệm:
+ Bước 1: Cắm 2 thanh kim loại vào quả khoai tây và không để chúng chạm vào nhau.
+ Bước 2: Lắp hệ thống như Hình 12.6. Ghi nhận giá trị hiện trên vôn kế.
Bài tập
Lời giải:
- Các cặp oxi hoá - khử:
- Thứ tự giảm dần tính oxi hóa của các ion kim loại trên: Ag+; Al3+; Mg2+; K+.
Phương pháp giải:
- Kim loại của cặp oxi hoá - khử có thế điện cực chuẩn nhỏ hơn có thể khử được cation kim loại của cặp oxi hoá - khử có thế điện cực chuẩn lớn hơn ở điều kiện chuẩn.
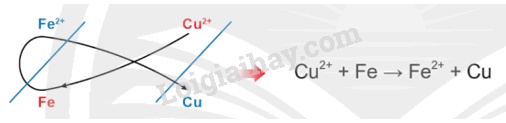
- Sử dụng quy tắc alpha để xác định chiều phản ứng:
Lời giải:
Chiều của phản ứng hóa học xảy ra giữa các cặp oxi hóa – khử: Kim loại của cặp oxi hoá - khử có thế điện cực chuẩn nhỏ hơn có thể khử được cation kim loại của cặp oxi hoá - khử có thế điện cực chuẩn lớn hơn ở điều kiện chuẩn.
- Cặp oxi hoá - khử: Cu2+/Cu, Zn2+/Zn
Vì nên Zn + Cu2+ → Zn2+ + Cu
- Cặp oxi hoá - khử: Cu2+/Cu, Ag+/Ag
Vì nên Cu + 2Ag+ → Cu2+ + 2Ag
- Cặp oxi hoá - khử: Zn2+/Zn, Ag+/Ag
Vì nên Zn + 2Ag+ → Zn2+ + 2Ag
Bài 3 trang 69 Hóa học 12: Trong pin điện hoá, quá trình khử
A. xảy ra ở cực âm.
B. xảy ra ở cực dương.
C. xảy ra ở cực âm và cực dương.
D. không xảy ra ở cả cực âm và cực dương.
Lời giải:
Trong pin điện hoá, quá trình khử xảy ra ở cực dương.
→ Chọn B.
Bài 4 trang 69 Hóa học 12: Khi pin Galvani Zn-Cu hoạt động thì nồng độ
A. Cu2+ giảm, Zn2+ tăng.
B. Cu2+ giảm, Zn2+ giảm.
C. Cu2+ tăng, Zn2+ tăng.
D. Cu2+ tăng, Zn2+ giảm.
Lời giải:
Khi pin Galvani Zn-Cu hoạt động, phản ứng xảy ra như sau: Zn + Cu2+ → Zn2+ + Cu
Do đó nồng độ Cu2+ giảm, Zn2+ tăng.
→ Chọn A.
A. Fe → Fe2+ + 2e
B. Fe2+ + 2e → Fe
C. Ag+ + le → Ag
D. Ag → Ag+ + 1e
Lời giải:
Vì nên cực âm là Fe.
Khi pin hoạt động, ở điện cực âm (anode) xảy ra quá trình oxi hoá kim loại: Fe → Fe2+ + 2e
→ Chọn A.
Lời giải:
- Pin : Fe2+/Fe và Cu2+/Cu
- Pin : Sn2+/Sn và Ag+/Ag
- Pin : Pb2+/Pb và Ag+/Ag
Lý thuyết Thế điện cực và nguồn điện hoá học
1. Cặp oxi hóa – khử của kim loại
- Xét một quá trình có ion kim loại Mn+ đóng vai trò là chất oxi hóa và một quá trình kim loại M đóng vai trò là chất khử như sau:
Mn+ + ne M
M Mn+ + ne
- Trong trường hợp trên, chất oxi hóa (dạng oxi hóa) Mn+ và chất khử (dạng khử). M thuộc cùng một nguyên tố kim loại. Quá trình trên được viết gọn như sau:
Mn+ + ne M
Dạng oxi hóa Dạng khử
- Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại đó.
2. Thế điện cực chuẩn của kim loại và pin galvani
- Pin Galvanin Zn – Cu gồm điện cực kẽm và điện cực đồng. Hai điện cực được nối với nhau bằng cầu muối. Khi pin hoạt động, ở điện cực âm (anode) xảy ra quá trình oxi hóa Zn và ở điện cực dương (cathode) xảy ra quá trình khử ion Cu2+.
- Thế điện cực chuẩn Eo của kim loại có thể xác định bằng cách đo sức điện động của pin tạo bởi điện cực hydrogen chuẩn và điện cực chuẩn của kim loại cần đo.
3. Ý nghĩa của dãy thế điện cực chuẩn kim loại
- Khi biết giá trị thế điện cực chuẩn của các cặp oxi hóa – khử, có thể so sánh được khả năng khử giữa các dạng khử và khả năng oxi hóa giữa các dạng oxi hóa ở điều kiện chuẩn.
- Kim loại trong cặp oxi hóa – khử có thế điện cực chuẩn âm có thể khử được ion hydrogen (H+) trong dung dịch acid ở điều kiện chuẩn
- Sức điện động chuẩn của pin điện hóa:
4. Một số loại pin khác
- Pin nhiên liệu: hoạt động dựa trên phản ứng oxi hóa – khử giữa nhiên liệu và chất oxi hóa. Pin nhiên liệu phổ biến hiện nay là pin hydrogen. Ưu điểm của pin nhiên liệu là nhiên liệu được bổ sung liên tục nên thời gian hoạt động của pin không bị hạn chế. Nhược điểm của pin nhiên liệu là công nghiệp chưa được phổ biến và giá thành cao.
- Pin mặt trời bao gồm nhiều tế bào quang điện làm biến đổi năng lượng ánh sáng thành ănng lượng điện. Ưu điểm tạo được nguồn năng lượng xanh, thân thiện với môi trường, chi phí không quá cao, sử dụng lâu dài tuy nhiên, pin mặt trời cần được lắp đặt trên không gian rộng để pin tiếp xúc trực tiếp với ánh sáng mặt trời. Loại pin này khó di chuyển
- Acquy đơn giản là acquy chì, gồm bản cực dương bằng PbO2, bản cực âm bằng Pb, cả hai điện cực được đặt vào dung dịch H2SO4 loãng.
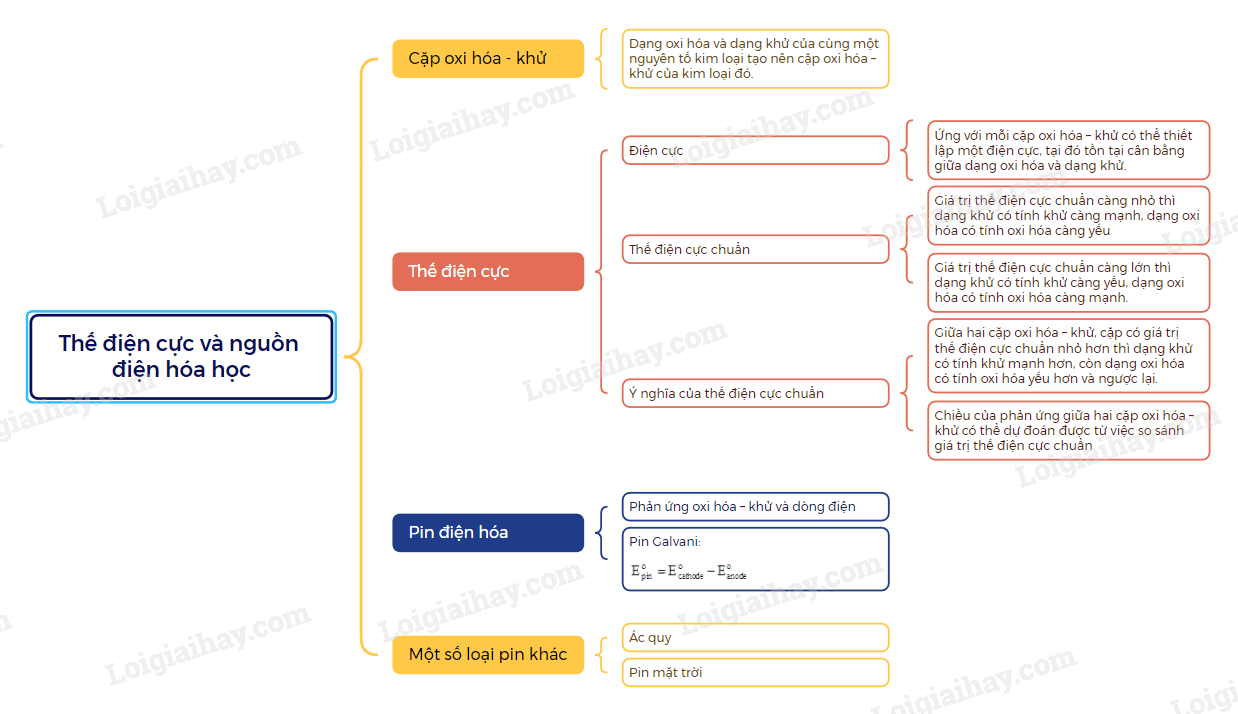
Sơ đồ tư duy Thế điện cực và Nguồn điện hóa học
Xem thêm các bài giải bài tập Hóa Học lớp 12 Chân trời sáng tạo hay, chi tiết khác:
Bài 11. Tơ – Cao su – Keo dán tổng hợp
Bài 12. Thế điện cực và nguồn điện hoá học
Bài 14. Đặc điểm cấu tạo và liên kết kin loại. Tính chất kim loại
Bài 15. Các phương pháp tách kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại