Với giải Luyện tập 3 trang 78 Hóa học lớp 12 Cánh diều chi tiết trong Bài 11: Nguồn điện hoá học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 11: Nguồn điện hoá học
Luyện tập 3 trang 78 Hóa học 12: Từ Bảng 10.1, hãy so sánh sức điện động chuẩn của pin Galvani Zn-Ni và Sn-Cu.
Lời giải:
Zn-Ni = - = –0,257 – (–0,763) = 0,506 V
Sn-Cu = - = 0,340 – (–0,138) = 0,478 V
So sánh: Sn-Cu < Zn-Ni
Lý thuyết Cấu tạo và nguyên tắc hoạt động của Pin Galvani
1. Cấu tạo
Một pin Galvani được tạo nên từ hai cặp oxi hóa – khử khác nhau (ví dụ Cu2+/Cu và Zn2+/Zn, gọi là pin Galvani Zn – Cu) thường có cấu tạo như sau:
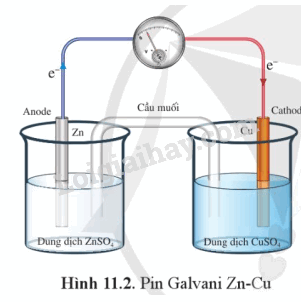
Hai dung dịch muối trong pin Galvani được nối với nhau bởi một cầu muối.
2. Nguyên tắc hoạt động
Nguyên tắc hoạt động của pin Galvani dựa trên phản ứng oxi hóa – khử tự diễn biến, trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.
Ví dụ:

3. Sức điện động của pin điện hóa
Sức điện động chuẩn cuẩ pin () tạo từ hai cặp oxi hóa – khử Xm+/X và Yn+/Y (trong đó ) được tính theo công thức sau:
Xem thêm lời giải bài tập Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Mở đầu trang 76 Hóa học 12: Quan sát hình dưới đây:...
Luyện tập 1 trang 77 Hóa học 12: Hãy mô tả cấu tạo mỗi pin Galvani sau:...
Câu hỏi 2 trang 78 Hóa học 12: Cho biết thế điện cực chuẩn của cặp = -0,763V và = 0,340V....
Thí nghiệm trang 79 Hóa học 12: Thực hành lắp pin đơn giản...
Câu hỏi 3 trang 81 Hóa học 12: Mỗi phát biểu sau đây là đúng hay sai?...
Bài 3 trang 82 Hóa học 12: Phát biểu nào sau đây là đúng khi nói về pin Galvani?...
Bài 4 trang 82 Hóa học 12: Những phát biểu nào sau đây là đúng?...
Bài 5 trang 82 Hóa học 12: Cho phản ứng trong một pin Galvani như sau:...
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 10. Thế điện cực chuẩn của kim loại
Bài 13. Cấu tạo và tính chất vật lí của kim loại