Lời giải bài tập Hóa học lớp 12 Bài 10: Thế điện cực chuẩn của kim loại sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 10: Thế điện cực chuẩn của kim loại
nX(s) + mYn+(aq) → nXm+(aq) + mY(s)
a) Phản ứng hoá học trên thuộc loại phản ứng nào?
b) Có thể dự đoán chiều của phản ứng hoá học trên dựa vào cơ sở nào?
Lời giải:
a) Phản ứng trên thuộc loại phản ứng oxi hóa-khử.
b) Có thể dự đoán chiều của phản ứng hoá học trên dựa vào thế điện cực chuẩn của kim loại.
Nguyên tắc:
Khi biết thế điện cực chuẩn của hai cặp oxi hóa – khử, có thể xác định được chất oxi hóa mạnh hơn và chất khử mạnh hơn, từ đó dự đoán được chiều diễn ra của phản ứng oxi hóa – khử ở điều kiện chuẩn.
Câu hỏi 1 trang 70 Hóa học 12: Cho hai phản ứng sau:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) (1)
Cu(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s) (2)
Hãy xác định chất oxi hoá, chất khử trong mỗi phản ứng trên.
Lời giải:
Phản ứng (1): Chất khử là Zn, chất oxi hóa là Cu2+
Phản ứng (2): Chất khử là Cu, chất oxi hóa là Ag+
Lời giải:
Phản ứng (1): Zn2+/Zn; Cu2+/Cu.
Phản ứng (2): Cu2+/Cu; Ag+/Ag.
Luyện tập 2 trang 71 Hóa học 12: Hãy viết cặp oxi hóa – khử của các kim loại trong dãy sau:
Lời giải:
Cặp oxi hóa khử: Mg2+/Mg; Al3+/Al; Zn2+/Zn; Fe2+/Fe; Fe3+/Fe; Fe3+/Fe2+; Sn2+/Sn; Pb2+/Pb; 2H+/H2; Cu2+/Cu; Cu+/Cu; Cu2+/Cu+; Ag+/Ag; Au3+/Au.
Lời giải:
<
⟹ Tính oxi hóa của Fe2+ yếu hơn tính oxi hóa của Pb2+.
Tính khử của Fe mạnh hơn tính khử của Pb.
Lời giải:
So sánh: = -2,173V < = -0,763V < = -0,257V < = 0V < = 1,520V.
⟹ Sắp xếp dãy các ion theo chiều tăng dần tính oxi hóa là:
Na+ < Zn2+ < Ni2+ < H+ < Au3+
Câu hỏi 3 trang 74 Hóa học 12: Phản ứng nào sau đây có thể xảy ra ở điều kiện chuẩn? Giải thích.
a) Cu(s) + Fe3+(aq) → ?
b) Ag(s) + Sn2+(aq) → ?
Lời giải:
a) = 0,771V > = 0,340V nên Fe3+ có tính oxi hóa mạnh hơn Cu2+, Cu có tính khử mạnh hơn Fe2+. Vậy ở điều kiện chuẩn phản ứng dưới đây có thể xảy ra:
Cu(s) + 2Fe3+(aq) → Cu2+(aq) + 2Fe2+(aq)
b) = 0,779V > = -0,138V nên Ag+ có tính oxi hóa mạnh hơn Sn2+, Sn có tính khử mạnh hơn Ag.Vậy ở điều kiện chuẩn phản ứng này không thể diễn ra.
Bài tập
Lời giải:
2M + 2nH+ ⟶ 2Mn+ + nH2
Dựa vào phản ứng ta thấy H+ có tính oxi hóa mạnh hơn Mn+, M có tính khử mạnh hơn H2 ⟹
Bài 2 trang 75 Hóa học 12: Cho các cặp oxi hoá khử sau:
a) Mg2+/Mg và Cu2+/Cu
b) Zn2+/Zn và Fe2+/Fe.
c) Ag+/Ag và Au3+/Au.
Viết các phương trình hóa học của phản ứng theo chiều tự diễn biến từ các cặp oxi hoá – khử tương ứng đã cho.
Lời giải:
a) Mg + Cu2+ ⟶ Mg2+ + Cu
b) Zn + Fe2+ ⟶Zn2+ + Fe
c) 3Ag + Au3+ ⟶ 3Ag+ + Au
(a) M là kim loại có tính khử mạnh.
(b) Ion M+ có tính oxi hoá yếu.
(c) M là kim loại có tính khử yếu.
(d) Ion M+ có tính oxi hoá mạnh.
Lời giải:
Những phát biểu đúng là: (a), (b).
Thế điện cực chuẩn của cặp M+/M (M là kim loại) bằng –3,040 V đây là giá trị tương đối thấp với cặp oxi hóa – khử của kim loại, chứng tỏ tính khử của kim loại M mạnh, tính oxi hóa của ion M+ yếu.
Lời giải:
= -0,440V > = -0,910V nên Fe2+ có tính oxi hóa mạnh hơn Cr2+, Cr có tính khử mạnh hơn Fe. Vậy ở điều kiện chuẩn phản ứng dưới đây có thể xảy ra:
Cr + Fe(NO3)2 ⟶ Cr(NO3)2 + Fe
Vậy thiết bị kim loại được mạ Cr không bền trong môi trường là dung dịch Fe(NO3)2.
Lý thuyết Thế điện cực chuẩn của kim loại
I. Cặp oxi hóa – khử của kim loại
- Xét một quá trình có ion kim loại Mn+ đóng vai trò là chất oxi hóa và một quá trình kim loại M đóng vai trò là chất khử như sau:
Mn+ + ne M
M Mn+ + ne
- Trong trường hợp trên, chất oxi hóa (dạng oxi hóa) Mn+ và chất khử (dạng khử). M thuộc cùng một nguyên tố kim loại. Quá trình trên được viết gọn như sau:
Mn+ + ne M
Dạng oxi hóa Dạng khử
- Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại đó.
II. Thế điện cực chuẩn của kim loại
1. Thế điện cực chuẩn
- Thế điện cực của cặp oxi hóa – khử của kim loại trong điều kiện chuẩn (nồng độ ion kim loại trong dung dịch là 1M, nhiệt độ 25oC) được gọi là thế điện cực chuẩn của kim loại, kí hiệu là
- Đơn vị thường sử dụng của thế điện cực là volt (V)
- Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu, tính oxi hóa của dạng oxi hóa càng mạnh và ngược lại.
2. Bảng thế điện cực chuẩn của kim loại và ứng dụng
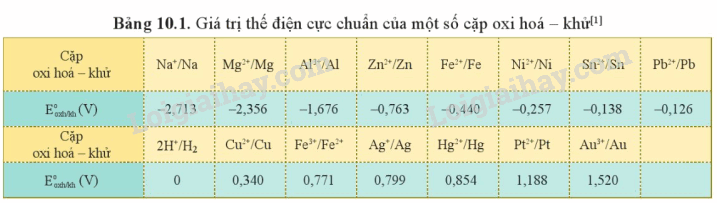
Nếu càng lớn thì
+ Tính oxi hóa của Mn+ càng mạnh.
+ Tính khử của M càng yếu

Dự đoán chiều phản ứng oxi hóa – khử
Nguyên tắc chung của phản ứng oxi hóa – khử xảy ra như sau:
- Chất oxi hóa mạnh hơn + Chất khử mạnh hơn Chất khử yếu hơn + Chất oxi hóa yếu hơn
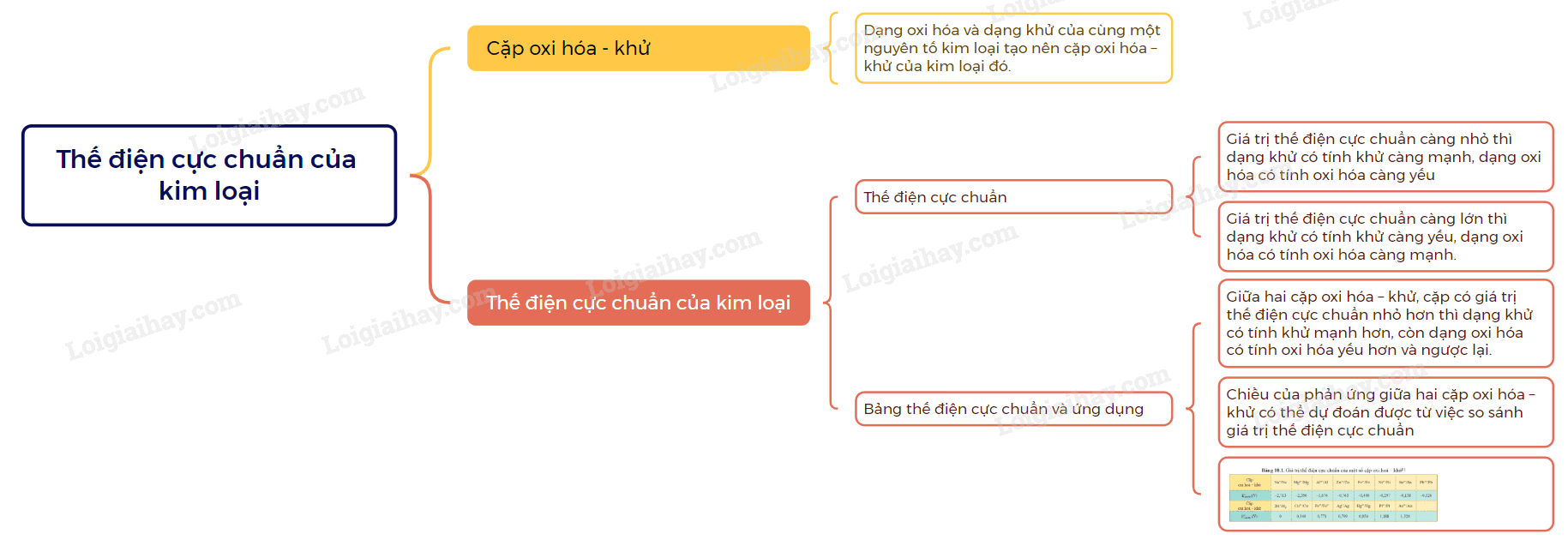
Sơ đồ tư duy Thế điện cực chuẩn của kim loại
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 10. Thế điện cực chuẩn của kim loại
Bài 13. Cấu tạo và tính chất vật lí của kim loại
Bài 14. Tính chất hoá học của kim loại