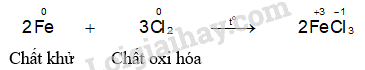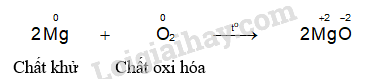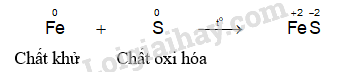Với giải Câu hỏi 5 trang 78 Hóa học lớp 12 Chân trời sáng tạo chi tiết trong Bài 14: Đặc điểm cấu tạo và liên kết kim loại. Tính chất kim loại giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 14: Đặc điểm cấu tạo và liên kết kim loại. Tính chất kim loại
Câu hỏi 5 trang 78 Hóa học 12: Tiến hành Thí nghiệm 1 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong các phản ứng hoá học xảy ra ở thí nghiệm này.
Phương pháp giải:
Hầu hết các kim loại (trừ Au, Pt,...) có thể phản ứng với chlorine tạo thành muối chloride.
Hầu hết các kim loại có thể phản ứng với oxygen (trừ Ag, Au, Pt) tạo thành các oxide tương ứng.
Nhiều kim loại có thể khử lưu huỳnh tạo thành các muối sulfide tương ứng. Phản ứng cần đun nóng (trừ Hg).
Lời giải:
- Hiện tượng phản ứng của thí nghiệm sắt phản ứng với chlorine: Sắt cháy sáng tạo thành khói màu nâu đỏ.
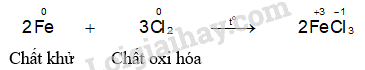
- Hiện tượng phản ứng của thí nghiệm magnesium phản ứng với oxygen: Magnesium cháy sáng chói, toả nhiều nhiệt.
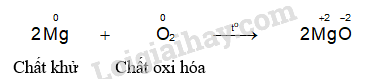
- Hiện tượng phản ứng của thí nghiệm sắt phản ứng với lưu huỳnh: Khi đốt nóng hỗn hợp, lưu huỳnh nóng chảy, hỗn hợp cháy sáng và bắt đầu chuyển thành hợp chất màu đen, phản ứng tỏa nhiều nhiệt.
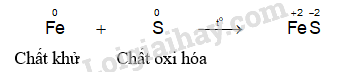
Lý thuyết Tính chất hóa học của kim loại
- Hầu hết các kim loại (trừ Au, Pt,…) có thể phản ứng với chlorine tạo thành muối chloride.
- Hầu hết các kim loại có thể phản ứng với oxygen (Trừ Ag, Au, Pt) tạo thành các oxide tương ứng.
- Nhiều kim loại có thể khử lưu huỳnh tạo thành các muối sulfide tương ứng. Phản ứng cần đun nóng (trừ Hg)
- Kim loại có thế điện cực chuẩn âm () có khả năng khử được ion H+ (dung dịch HCl, H2SO4 loãng) ở điều kiện chuẩn, giải phóng khí H2
- Kim loại có thế điện cực chuẩn ) có khả năng khử được H2O ở điều kiện thường, giải phóng khí H2.
- Kim loại có thế điện cực nhỏ hơn có khả năng khử được ion kim loại có thế điện cực chuẩn lớn hơn trong dung dịch muối ở điều kiện chuẩn.
Xem thêm lời giải bài tập Hóa học lớp 12 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 75 Hóa học 12: Kim loại giữ vai trò quan trọng trong các ngành kĩ thuật vì chúng có những tính chất vật lí, hoá học đặc biệt. Kim loại có cấu tạo nguyên tử như thế nào? Có những tính chất và ứng dụng gì?...
Câu hỏi 1 trang 75 Hóa học 12: Hãy nêu nhận xét về số electron lớp ngoài cùng của các nguyên tử kim loại Na, Mg, Al, Fe, Cu, Zn....
Câu hỏi 2 trang 76 Hóa học 12: So sánh liên kết kim loại với liên kết ion và liên kết cộng hoá trị....
Câu hỏi 3 trang 77 Hóa học 12: Vàng, bạc được sử dụng làm đồ trang sức nhờ tính chất vật lí nào của kim loại?...
Câu hỏi 4 trang 77 Hóa học 12: Hãy cho biết hiện tượng xảy ra khi tác dụng một lực cơ học đủ mạnh lên tấm kim loại. Giải thích....
Luyện tập trang 78 Hóa học 12: Hãy giải thích:...
Câu hỏi 5 trang 78 Hóa học 12: Tiến hành Thí nghiệm 1 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong các phản ứng hoá học xảy ra ở thí nghiệm này....
Câu hỏi 6 trang 79 Hóa học 12: Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng phản ứng được với dung dịch HCl hoặc dung dịch H2SO4 loãng giải phóng khí H2....
Câu hỏi 7 trang 79 Hóa học 12: Tiến hành Thí nghiệm 2 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong phản ứng hoá học xảy ra ở Thí nghiệm 2....
Câu hỏi 8 trang 80 Hóa học 12: Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng phản ứng được với nước ở điều kiện thường giải phóng khí H2....
Câu hỏi 9 trang 80 Hóa học 12: Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng đẩy được đồng ra khỏi dung dịch CuSO4 1 M....
Câu hỏi 10 trang 80 Hóa học 12: Tiến hành Thí nghiệm 3 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong phản ứng hoá học xảy ra ở Thí nghiệm 3....
Bài 1 trang 80 Hóa học 12: Thuỷ ngân dễ bay hơi và rất độc. Khi nhiệt kế thuỷ ngân bị vỡ có thể dùng bột lưu huỳnh để xử lí thuỷ ngân. Giải thích....
Bài 2 trang 80 Hóa học 12: Tại sao đồng dẫn điện tốt hơn nhôm nhưng dây điện cao thế thường được làm bằng nhôm mà không làm bằng đồng? cho biết khối lượng riêng của đồng là 8,96 g/cm3, của nhôm là 2,70 g/cm3....
Bài 3 trang 80 Hóa học 12: Để làm tinh khiết bột đồng có lẫn các kim loại thiếc, kẽm, người ta có thể ngâm hỗn hợp trên vào lượng dư dung dịch Cu(NO3)2. Giải thích và viết phương trình hoá học của các phản ứng xảy ra (nếu có)....
Xem thêm các bài giải bài tập Hóa Học lớp 12 Chân trời sáng tạo hay, chi tiết khác:
Bài 13. Điện phân
Bài 14. Đặc điểm cấu tạo và liên kết kin loại. Tính chất kim loại
Bài 15. Các phương pháp tách kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại
Bài 17. Nguyên tố nhóm IA
Bài 18. Nguyên tố nhóm IIA