Lời giải bài tập Hóa học lớp 12 Bài 13: Điện phân sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 13: Điện phân
Khi điện phân, các quá trình trên bề mặt điện cực xảy ra theo nguyên tắc nào? Điện phân có ứng dụng gì trong đời sống, sản xuất?
Lời giải:
- Nguyên tắc điện phân:
+ Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
+ Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
- Ứng dụng: điều chế, tinh chế một số kim loại, mạ điện,...
Lời giải:
Sản phẩm tạo thành ở hai điện cực khi điện phân NaCl nóng chảy:
- Cathode: Na.
- Anode: Cl2.
Lời giải:
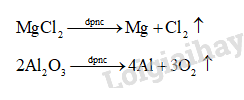
Câu hỏi 2 trang 71 Hóa học 12: Tiến hành Thí nghiệm 1 và nêu hiện tượng quan sát được.
Phương pháp giải:
Dựa vào phương trình điện phân để nêu hiện tượng:
![]()
Lời giải:
Hiện tượng: kim loại đồng (màu đỏ) bám vào cathode, sủi bọt khí không màu (O2) thoát ra ở anode.
Lời giải:
- Ion Cu2+ di chuyển về điện cực âm (cathode).
- Ion di chuyển về điện cực dương (anode).
Câu hỏi 4 trang 72 Hóa học 12: Tiến hành Thí nghiệm 2 và nêu hiện tượng xảy ra. Giải thích.
Phương pháp giải:
Dựa vào phương trình điện phân để nêu hiện tượng:
![]()
Dựa vào sơ đồ điện phân để giải thích.
Lời giải:
- Hiện tượng: ở cả hai điện cực đều thoát ra khí không màu.
- Giải thích: Xét sơ đồ điện phân
Cathode (-) NaCl Anode (+)
Na+, H2O H2O Cl-, H2O
Lời giải:
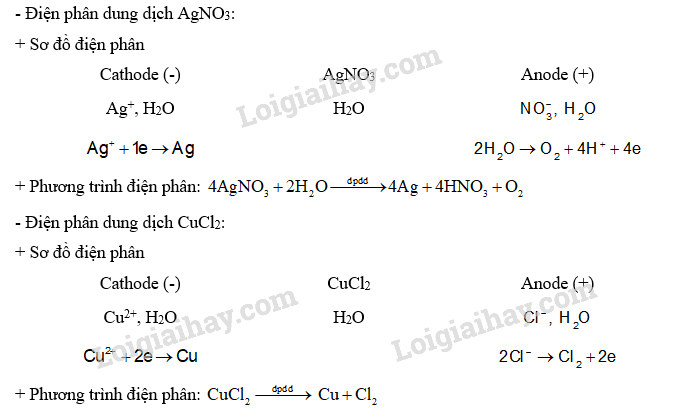
Lời giải:
- Sản xuất kim loại: Trong công nghiệp, các kim loại mạnh (Na, K, Ca, Mg, Al,…) được điều chế bằng phương pháp điện phân nóng chảy, các kim loại yếu và trung bình được điều chế bằng phương pháp điện phân dung dịch.
- Tinh chế kim loại: các kim loại từ nguồn kim loại thô được tinh chế bằng phương pháp điện phân.
- Mạ điện: ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.
Bài tập
Bài 1 trang 74 Hóa học 12: Điện phân CaCl2 nóng chảy, ở cathode xảy ra quá trình nào?
A. Oxi hoá ion Ca2+.
B. Khử ion Ca2+.
C. Oxi hoá ion Cl-.
D. Khử ion Cl-.
Phương pháp giải:
Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
Lời giải:
Điện phân CaCl2 nóng chảy, ở cathode xảy ra quá trình khử Ca2+:
→ Chọn B.
Lời giải:
Ở anode, ion không bị điện phân, H2O bị điện phân:
hay có thể viết
→ Chọn A.
Phương pháp giải:
Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
Lời giải:
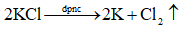
Lời giải:
- Sử dụng bình mạ điện chứa dung dịch CuCl2, thanh kim loại đồng (anode) và vật dụng bằng sắt (cathode).
- Trong bình mạ điện sẽ xảy ra các quá trình khử anode (+):
Đồng tan và bám vào cathode (vật dụng bằng sắt).
Lý thuyết Điện phân
1. Điện phân nóng chảy, điện phân dung dịch
- Nguyên tắc điện phân nóng chảy
+ Tại cathode (điện cực âm): xảy ra quá trình khử ion dương
+ Tại anode (điện cực dương): xảy ra quá trình oxi hóa ion âm
- Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hóa mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn
2. Ứng dụng
- Phương pháp điện phân có nhiều ứng dụng trong thực tiễn, đặc biệt là điều chế, tinh chế một số kim loại, mạ điện,…
Sơ đồ tư duy Điện phân

Xem thêm các bài giải bài tập Hóa Học lớp 12 Chân trời sáng tạo hay, chi tiết khác:
Bài 12. Thế điện cực và nguồn điện hoá học
Bài 14. Đặc điểm cấu tạo và liên kết kin loại. Tính chất kim loại
Bài 15. Các phương pháp tách kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại