Tailieumoi.vn giới thiệu Giải bài tập Hóa Học lớp 11 Bài 17: Silic và hợp chất của silic chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Silic và hợp chất của silic lớp 11.
Giải bài tập Hóa Học lớp 11 Bài 17: Silic và hợp chất của silic
Bài 1 trang 79 sgk hóa học 11: Nêu những tính chất hóa học giống và khác nhau giữa silic và cacbon. Viết các phương trình hóa học để minh họa ?
Phương pháp giải:
- Giống nhau: C và Si đều thể hiện tính khử hoặc tính oxi hóa trong các phản ứng hóa học
+ ví dụ: tác dụng với oxi, tác dụng với kim loại
- Khác nhau:
+ C có tính khử mạnh hơn Si nên khử được một số oxit kim loại
+ Si có khả năng tác dụng được với dung dịch NaOH
Lời giải:
- C và Si đều thể hiện tính khử hoặc tính oxi hóa trong các phản ứng hóa học
+ Đều có tính oxi hóa: ( tác dụng được với một số kim loại)
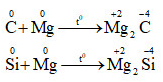
+ Đều có tính khử : ( tác dụng với một số phi kim)
- Khác nhau:
+ Si tác dụng mạnh được với dung dịch kiềm giải phóng khí H2 còn C thì không
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
+ C khử được một số oxit kim loại còn Si thì không khử được
C + 2FeO 2Fe + CO2↑
Bài 2 trang 79 sgk hóa học 11: Số oxi hóa cao nhất của silic thể hiện ở hợp chất nào sau đây?
A. SiO
B. SiO2
C. SiH4
D. Mg2Si
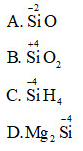
Bài 3 trang 79 sgk hóa học 11: Khi cho nước tác dụng với oxit axit thì axit sẽ không được tạo thành, nếu oxit axit đó là:
A. Cacon đioxit
B. Lưu huỳnh đioxit
C. Silic đioxit
D. Đinitơ pentaoxit
SiO2 không tan trong nước
Đáp án C
Bài 4 trang 79 sgk hóa học 11: Từ SiO2 và các hóa chất cần thiết khác, hãy viết phương trình hóa học của các phản ứng điều chế axit silixic?
Có thể viết PTHH theo sơ đồ:
SiO2 NaSiO3 H2SiO3
Lời giải:
SiO2 NaSiO3 H2SiO3
Các phương trình hóa học:
SiO2 + 2NaOH → Na2SiO3 + H2O
Na2SiO3 + CO2 + H2O → H2SiO3↓+ Na2CO3
Bài 5 trang 79 sgk hóa học 11: Phương trình ion rút gọn: 2H+ + SiO32- → H2SiO3↓ ứng với phản ứng nào giữa các chất nào sau đây?
A. Axit cacbonic và canxi silicat
B. Axit cacbonic và natri silicat
C. Axit clohiđrit và canxi silicat
D. Axit clohiđrit và natri silicat
Lời giải:
A. H2CO3 là axit yếu + CaSiO3 không có phản ứng
B. H2CO3 là axit yếu + Na2SiO3 không có phản ứng
C. HCl + CaSiO3 (không phân ly ra )
D. Phương trình ion:
Phương trình ion rút gọn:
Đáp án D
Bài 6 trang 79 sgk hóa học 11: Cho hỗn hợp silic và than có khối lượng 20,0g tác dụng với lượng dư dung dịch NaOH đặc, đun nóng. Phản ứng giải phóng ra 13,44 lít khí hidro (đktc)
Xác định thành phần phần trăm khối lượng của silic trong hỗn hợp ban đầu, biết rằng phản ứng xảy ra với hiệu suất 100%
Thành phần chính của than chính là C. Khi cho Si và C tác dụng với NaOH đặc đun nóng chỉ có Si tham gia phản ứng
Viết PTHH:
Si + 2NaOH đặc + H2O Na2SiO3 + 2H2↑
Tính số mol Si theo số mol H2 : nSi = ½. nH2 = ? (mol)
=> khối lượng Si : mSi = nSi. MSi = ? (g)
=> %Si trong hỗn hợp ban đầu
Lời giải:
PTHH
Si + 2NaOH (đ) + H2O Na2SiO3 + 2H2↑
1mol 2mol
0,30 mol 0,60 mol
%mSi
Lý thuyết Bài 17: Silic và hợp chất của silic
A. SILIC
I. VỊ TRÍ
Trong bảng tuần hoàn silic ở ô thứ 14, nhóm IVA, chu kì 3. Cấu hình electron: 1s22s22p63s23p2.
II. TÍNH CHẤT VẬT LÍ
Có các dạng thù hình là silic tinh thể và silic vô định hình
- Silic tinh thể có cấu trúc giống kim cương, màu xám, có ánh kim và có tính bán dẫn
- Silic vô định hình là chất bột màu nâu
III. TÍNH CHẤT HÓA HỌC
- Silic có các số oxi hóa: -4, 0, +2 và +4 (số oxi hóa +2 ít đặc trưng hơn).
- Trong các phản ứng hóa học, silic vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
1. Tính khử
a) Tác dụng với phi kim:
Si + 2F2 → SiF4
Si + O2 SiO2
b) Tác dụng với hợp chất:
2NaOH + Si + H2O → Na2SiO3 + 2H2
2. Tính OXH
- Tác dụng với một số kim loại mạnh ở nhiệt độ cao:
2Mg + Si Mg2Si
IV. ỨNG DỤNG
- Silic siêu tinh khiết là chất bán dẫn dùng trong kỹ thuật vô tuyến và điện tử như chế tạo tế bào quang điện, bộ khuếch đại,...
- Trong luyện kim silic được dùng để tách oxi ra khỏi kim loại nóng chảy
V. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
2Mg + SiO2 2MgO + Si (900oC)
2. Trong công nghiệp
SiO2 + 2C 2CO + Si (1800oC)
B. HỢP CHẤT CỦA SILLIC
I. SiO2
1. Tính chất vật lý
Ở dạng tinh thể nguyên tử màu trắng rất cứng, không tan trong nước, có tso và tnco rất cao, tồn tại ở dạng cát và thạch anh là nguyên liệu quan trọng để sản xuất thủy tinh.
2. Tính chất hóa học
a) Tan chậm trong dung dịch kiềm đặc nóng, tan nhanh trong kiềm nóng chảy hoặc cacbonat kim loại kiềm nóng chảy
SiO2 + 2NaOH Na2SiO3 + H2O
SiO2 + Na2CO3 Na2SiO3 + CO2
b) Tác dụng với HF ( dùng phản ứng này để khắc chữ, tranh lên thủy tinh)
SiO2 + 4HF → SiF4 + 2H2O
II. H2SiO3
1. Tính chất vật lý
Là axit rất yếu (yếu hơn H2CO3) , ở dạng keo, không tan trong nước. Khi bị mất nước thì tạo thành xốp silicagen, thường được dùng để hút ẩm trong các thùng hàng hóa
2. Tính chất hóa học
a) Phản ứng nhiệt phân:
H2SiO3 SiO2 + H2O
b) Tác dụng được với axit cacbonic :
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3
III. MUỐI SILICAT
- Chỉ có muối của kim loại kiềm tan được trong nước.
Na2SiO3 + 2H2O ↔ 2NaOH + H2SiO3
- Dung dịch đậm đặc của Na2SiO3 và K2SiO3 được gọi là thủy tinh lỏng, dùng để chế tạo keo dán thủy tinh và sứ,...
Sơ đồ tư duy: Silic và hợp chất của silic
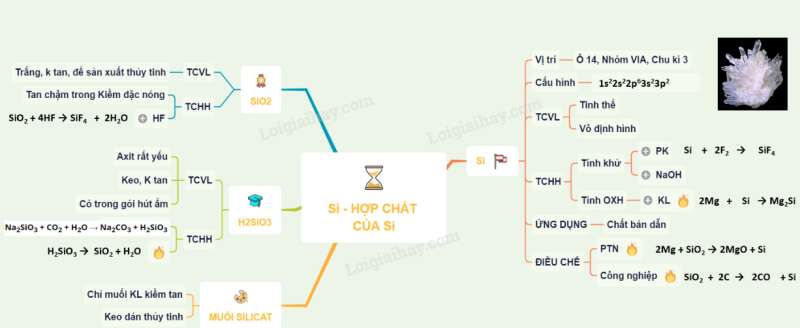
Dạng 1: Lý thuyết về silic và hợp chất của silic
Ví dụ 1: Phản ứng hóa học nào sau đây không đúng
A. SiO2 + H2O → H2SiO3
B. 3CO + Fe2O3 2 Fe + 3CO2
C. CO2 + 2Mg C + 2MgO
D. SiO2 + 4HF → SiF4 + 2H2O
Hướng dẫn giải chi tiết:
Phản ứng hóa học không đúng là:
SiO2 + H2O → H2SiO3
Đáp án A
Ví dụ 2: Trong phản ứng hóa học nào sau đây silic đóng vai trò là chất oxi hóa
A. Si + 2F2→ SiF4
B. Si + O2 SiO2
C. Si + 2NaOH + H2O → Na2SiO3 + 2H2
D. 2Mg + Si Mg2Si
Hướng dẫn giải chi tiết:
Si đóng vai trò là chất oxi hóa khi tác dụng với chất khử (kim loại), sau phản ứng số oxi hóa của Si giảm
Đáp án D
Ví dụ 3: Silic đioxit và nhôm oxit cùng phản ứng với chất nào sau đây?
A. O2.
B. Mg.
C. dd Ba(OH)2 đặc, nguội.
D. dd KOH đặc, nóng.
Hướng dẫn giải chi tiết:
- A loại vì SiO2 và Al2O3 đều không phản ứng với O2
- B loại vì Mg không phản ứng với Al2O3
- C loại vì SiO2 không phản ứng với Ba(OH)2 đặc ở nhiệt độ thường
- D đúng
PTHH: SiO2 + 2KOH K2SiO3 + H2O
Al2O3 + 2KOH → 2KAlO2 + H2O
Đáp án D
Ví dụ 4: Cho sơ đồ sau:
Si SiO2 Na2SiO3 H2SiO3.
Các chất cần lấy trong phản ứng (1), (2), (3) là:
A. O2; Na2O; HCl.
B. O2; Na2O; H2O.
C. O2; NaOH; HCl.
D. O2; NaOH; H2.
Hướng dẫn giải chi tiết:
Si SiO2 Na2SiO3 H2SiO3.
PTHH:
(1) Si + O2 SiO2
(2) SiO2 + 2NaOH → Na2SiO3 + H2O
(3) Na2SiO3 + 2HCl → NaCl + H2SiO3
Đáp án C
Ví dụ 5: Người ta có thể điều chế Si bằng cách
A. Dùng than cốc khử SiO2 trong lò điện ở nhiệt độ cao
B. Đốt cháy hỗn hợp bột Mg và cát nghiền mịn
C. Đốt cháy hỗn hợp bột Mg và cát nghiền mịn
D. cả A, B đều đúng
Hướng dẫn giải chi tiết:
A. Cách điều chế Si trong công nghiệp:
SiO2 + 2C -> Si + 2CO => đúng
B. Cách điều chế Si trong PTN:
2Mg + SiO2 -> 2MgO + Si => đúng
C. Si không tồn tại dạng đơn chất
=> không có quặng silic đơn chất trong tự nhiên => loại
Đáp án D
Dạng 2: Bài tập về tính chất hóa học cúa Silic và Silic dioxit
* Một số lưu ý cần nhớ
I. Silic:
Silic là phi kim kém hoạt động, ở nhiệt độ cao có khả năng thể hiện cả tính khử và tính OXH
* Tính khử:
- Tác dụng với phi kim:
Si + 2F2 → SiF4
Si + O2 SiO2
- Tác dụng với hợp chất:
2NaOH + Si + H2O → Na2SiO3 + 2H2
* Tính oxi hóa:
- Tác dụng với một số kim loại mạnh ở nhiệt độ cao:
2Mg + Si Mg2Si
II. SiO2
Là oxit axit,
Tan chậm trong dung dịch kiềm đặc nóng, tan nhanh trong kiềm nóng chảy hoặc cacbonat kim loại kiềm nóng chảy
SiO2 + 2NaOH Na2SiO3 + H2O
SiO2 + Na2CO3 Na2SiO3 + CO2
Tác dụng với HF ( dùng phản ứng này để khắc chữ, tranh lên thủy tinh)
SiO2 + 4HF → SiF4 + 2H2O
III. H2SiO3
Tính chất hóa học:
- Phản ứng nhiệt phân:
H2SiO3 SiO2 + H2O
- Tác dụng được với axit cacbonic :
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3
IV. Muối silicat:
Chỉ có muối của kim loại kiềm tan được trong nước.
Na2SiO3 + 2H2O → 2NaOH + H2SiO3
Dung dịch đậm đặc của Na2SiO3 và K2SiO3 được gọi là thủy tinh lỏng, dùng để chế tạo keo dán thủy tinh và sứ,...
* Một số ví dụ điển hình
Ví dụ 1: Một loại thủy tinh có chứa 13% Na2O; 11,7% CaO; 75,3% SiO2 về khối lượng. Thành phần của thủy tinh này được viết dưới dạng hợp chất các oxit là
A. Na2O.CaO.6SiO2
B. 2Na2O.6CaO.6SiO2
C. 2Na2O.CaO.6SiO2
D. Na2O.6CaO.SiO2
Hướng dẫn giải chi tiết:
Công thức thủy tinh có dạng: xNa2O.yCaO.zSiO2
Đáp án A
Ví dụ 2: Cho m gam silic tác dụng vừa đủ với dung dịch NaOH. Sau phản ứng thấy khối lượng dung dịch tăng 2,4 gam. Giá trị của m là:
A. 1,4 gam.
B. 2,58 gam.
C. 2,8 gam.
D. 2,4 gam.
Hướng dẫn giải chi tiết:
Giả sử nSi = x (mol)
Si + 2NaOH + H2O → Na2SiO3 + 2H2
x → 2x
mdd tăng = mSi - mH2 = 2,4 => 28x – 4x = 2,4
=> x = 0,1 mol => m = 2,8 gam
Đáp án C
Ví dụ 3: Cho 11 gam hỗn hợp 2 kim loại Al, Si tan hoàn toàn vào dung dịch NaOH thu được 15,68 lít H2 (đktc). Thành phần phần trăm khối lượng của Si trong hỗn hợp là
A. 50,00%.
B. 51,19%
C. 50,91%.
D. 51,90%.
Hướng dẫn giải chi tiết:
nH2 = 0,7 (mol). Gọi số mol của Al và Si lần lượt là x, y (mol)
+mhh = mAl + mSi => 27x + 28y = 11 (1)
+ BT electron: 3nAl + 4nSi = 2nH2 => 3x + 4y = 0,7.2 (2)
Giải hệ (1) và (2) được: x = y = 0,2 mol
=> %mSi = = 50,91%
Đáp án C